填补抗VEGF治疗空白,依沃西单抗为晚期肺鳞癌患者带来长PFS获益
医脉通 2025.07.21

免疫2.0时代 实例先锋
12条内容
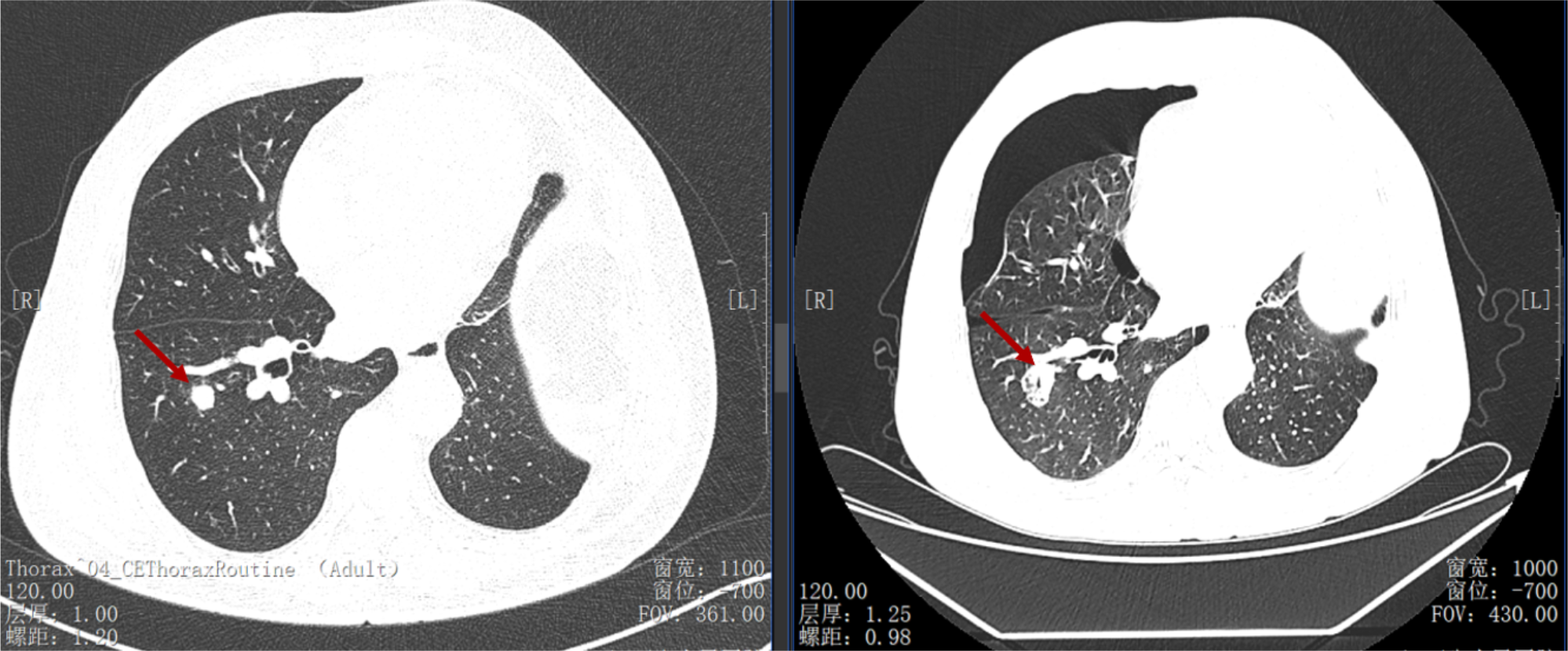
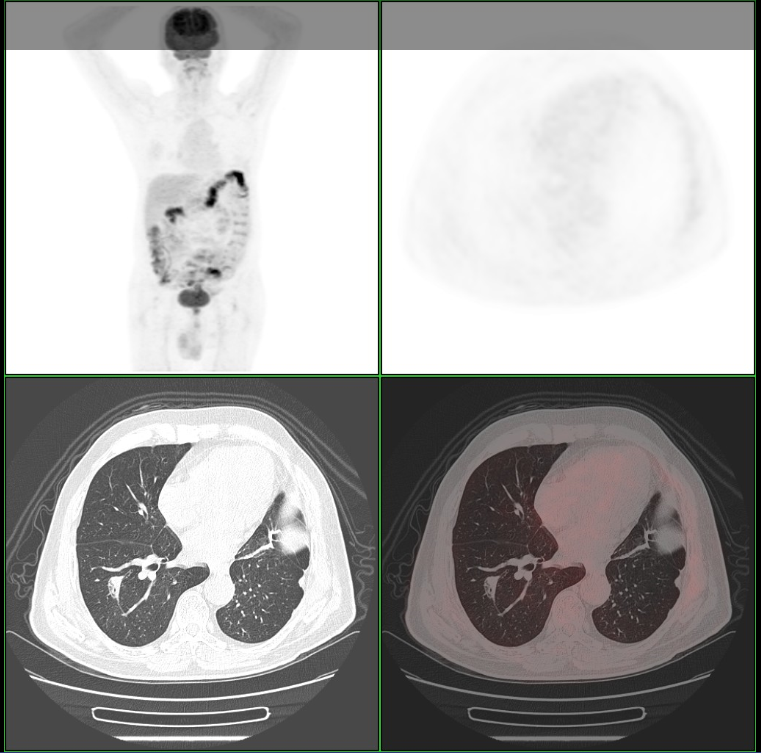
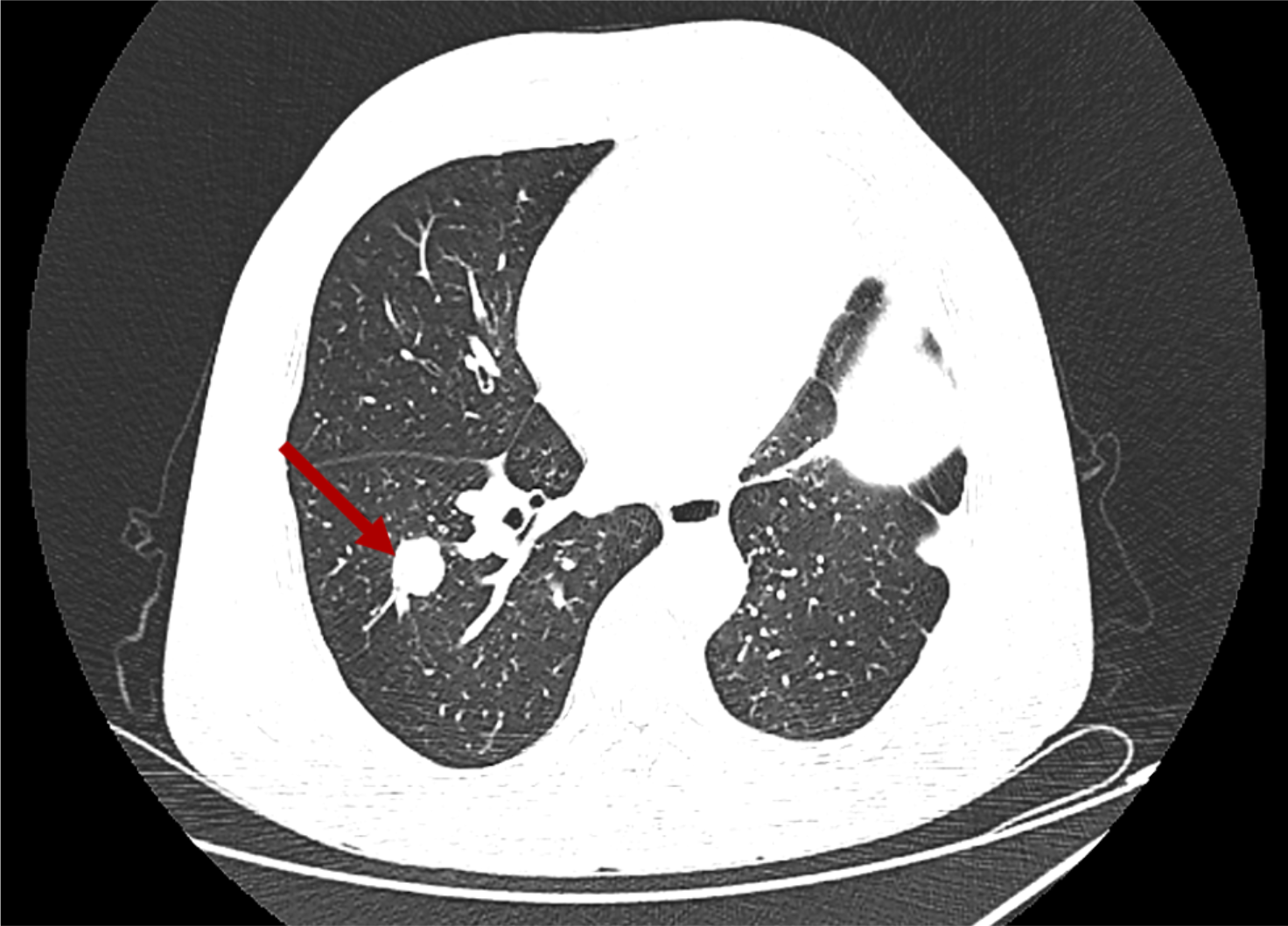
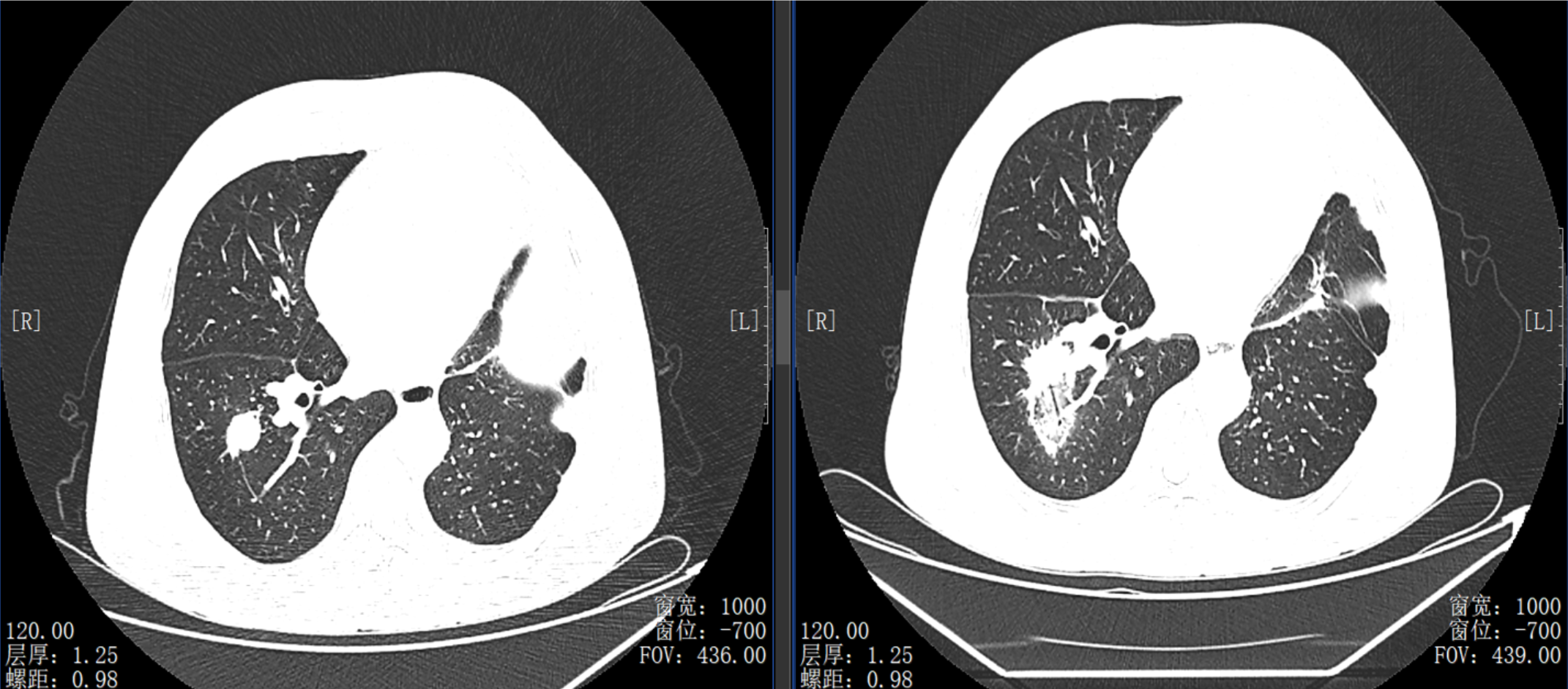
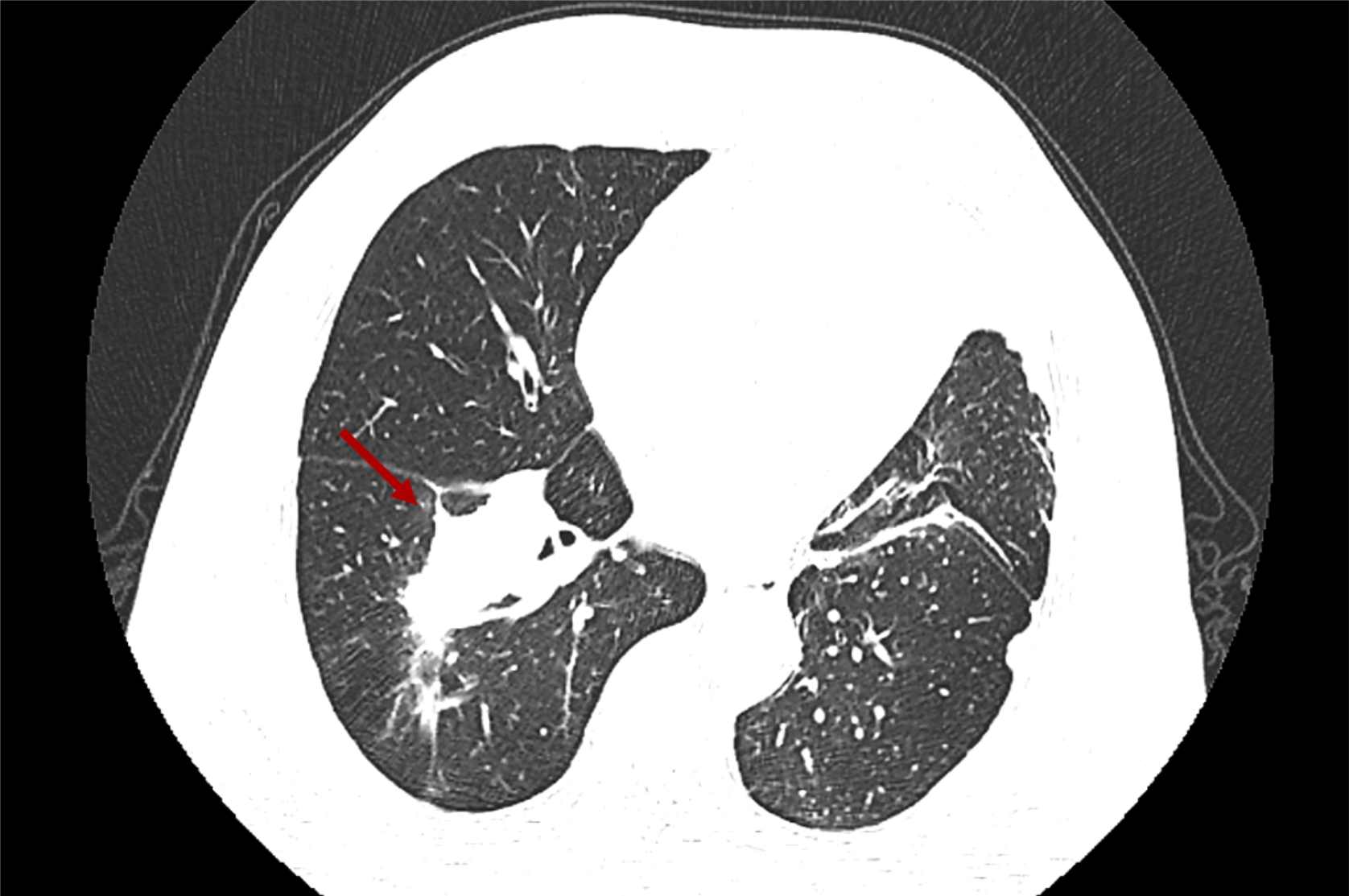
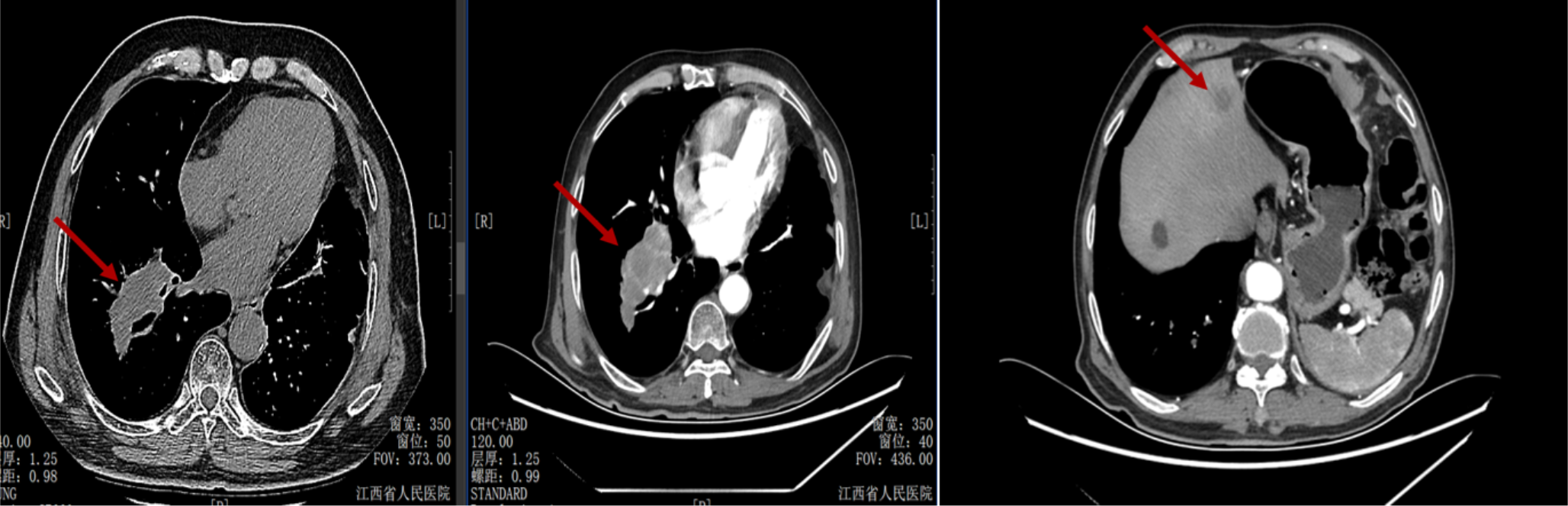
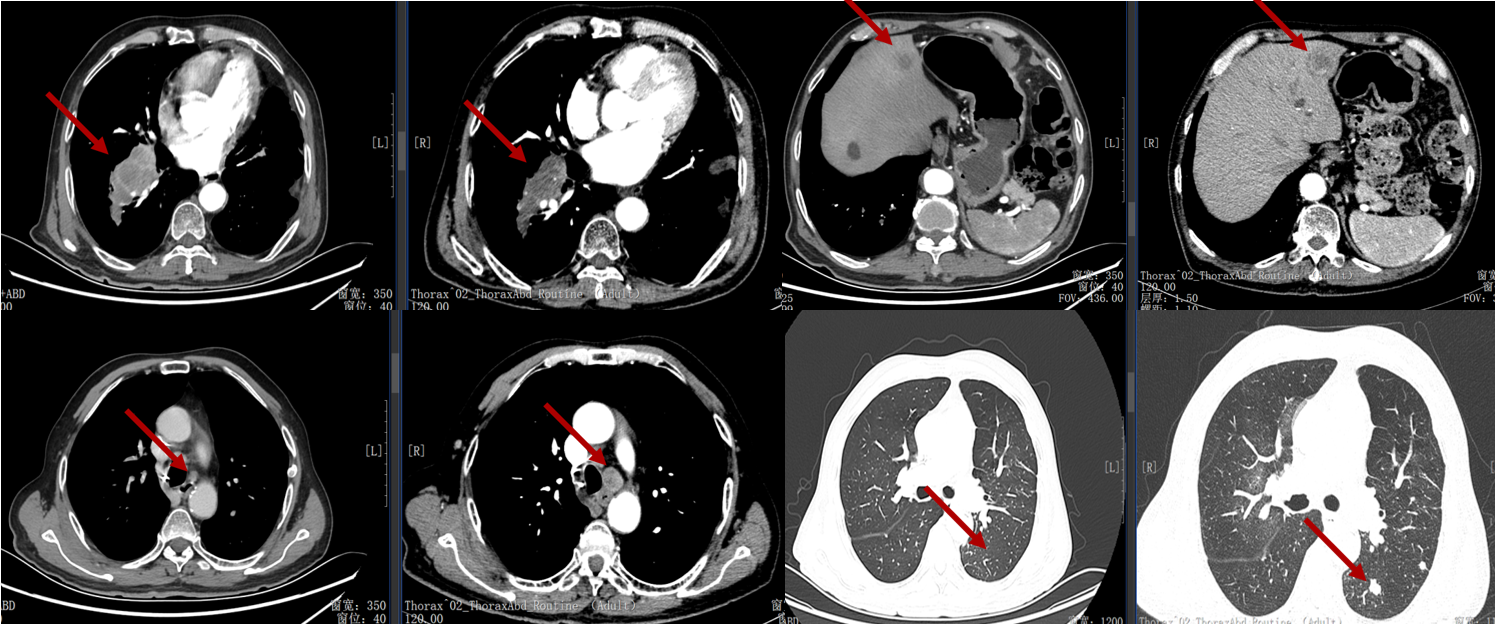
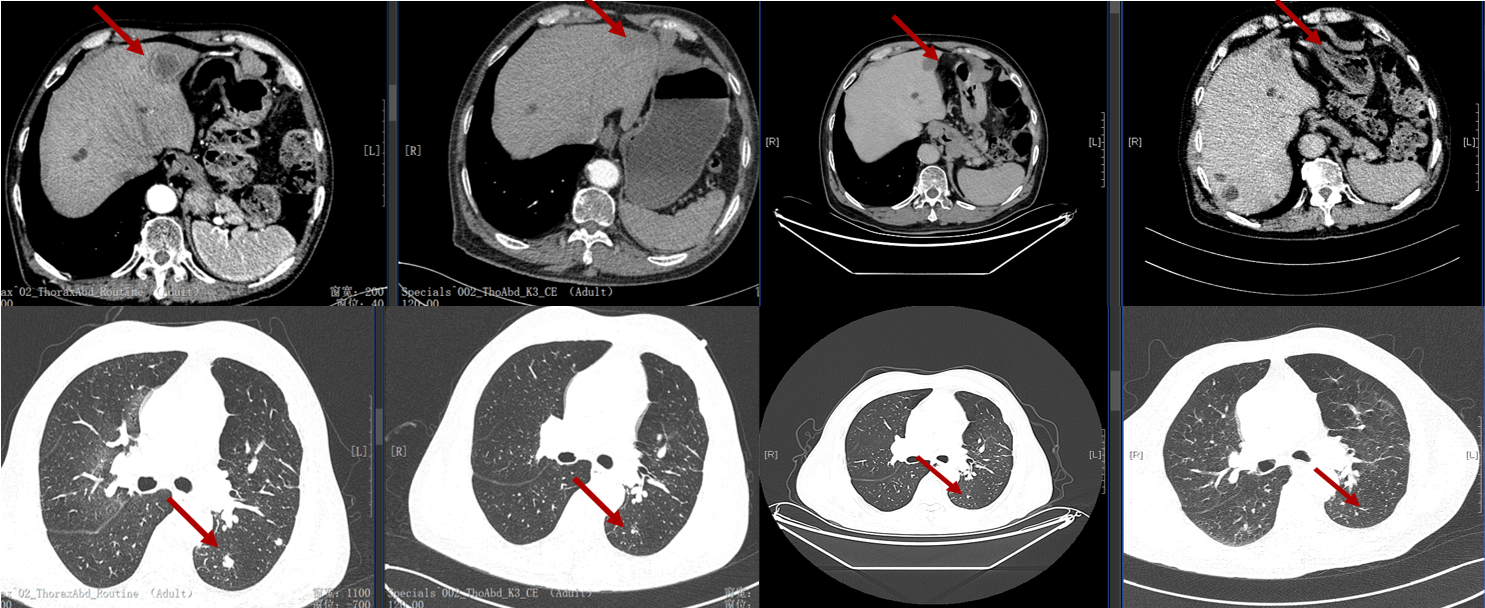
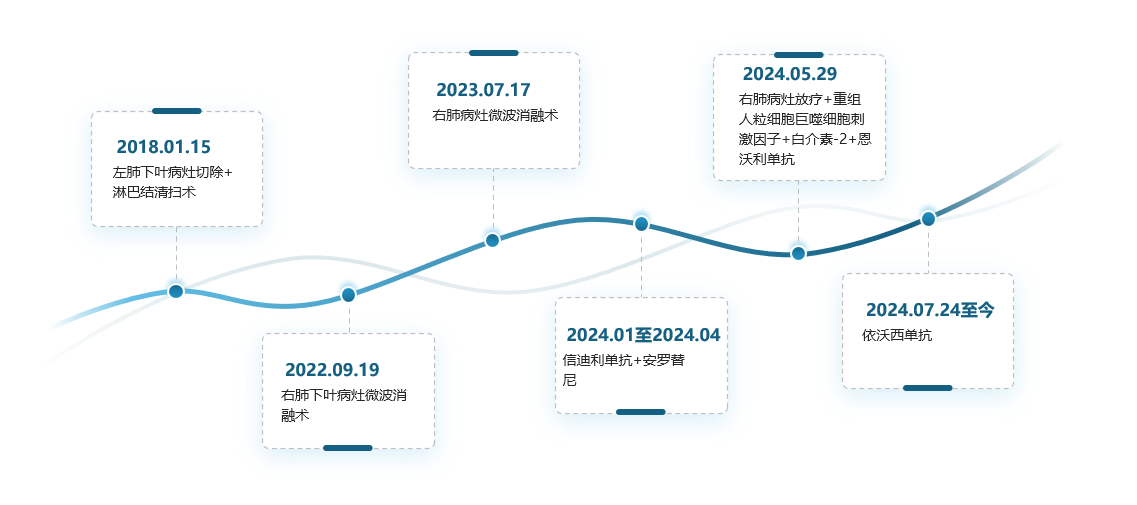
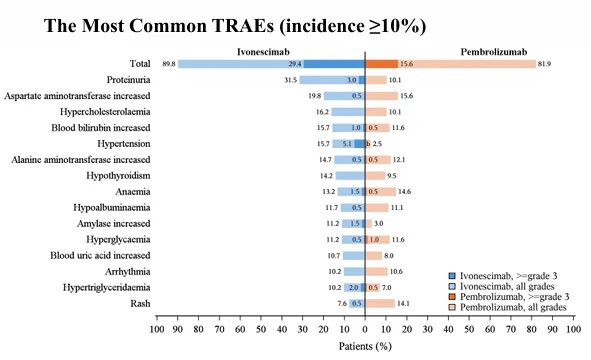
导读 无论从循证、指南还是实践的角度,免疫治疗都已改变了驱动基因阴性晚期非小细胞肺癌(NSCLC)患者的治疗格局,成为其一线标准治疗方案 [1]。而NSCLC主要包括肺腺癌和肺鳞癌,因肺鳞癌多位于中心位置,易于出血和坏死,胸苷酸合成酶含量高,此外还缺乏 EGFR 等有效靶点,因而患者从抗血管生成药物、培美曲塞等化疗药物以及靶向治疗药物中罕有获益或安全性不佳。多年来肺鳞癌临床诊疗研究进展缓慢,因此患者在治疗选择上也更加受限。近年来,随着免疫治疗在NSCLC领域的持续探索,针对晚期肺鳞癌患者的治疗策略取得了显著突破[2,3]。然而,在真实世界中,单一机制的免疫治疗药物逐渐显现出疗效瓶颈,而依沃西单抗为一种抗PD-1/VEGF双特异性抗体,可通过其全新机制发挥抗肿瘤作用,为患者带来更优的生存获益[4-6]。 本文将分享一例老年晚期肺鳞癌患者接受依沃西单抗单药治疗的真实案例。该患者既往接受过PD-1或PD-L1抑制剂治疗,但未能获得理想的临床疗效。在接受依沃西单抗治疗后,患者不仅实现了持续的部分缓解(PR),无进展生存期(PFS)更是接近一年,充分验证了依沃西单抗的卓越疗效。该病例由江西省人民医院姚伟荣教授提供,并由苏州大学附属第二医院张力元教授进行深度点评,旨在为临床实践提供重要参考依据,并探讨依沃西单抗在晚期肺鳞癌患者中的应用潜力。 基本信息 患者:男性,74岁。 主诉: 左肺肺恶性肿瘤术后4年余。 现病史: 2018年1月份因咳嗽咳痰就诊南昌大学第一附属医院,支气管镜检查提示左肺下叶背段开口见菜花状新生物,病理提示肺鳞状细胞癌。2018-1-15行胸腔镜下左肺下叶病灶切除+淋巴结清扫术,术后病理:(左下肺)鳞状细胞癌,侵犯透明软骨,支气管切缘阴性,支气管旁淋巴结(0/3)阴性,第10组淋巴结(0/1)阴性。后拒绝行任何抗肿瘤治疗,定期复查。 既往史: 高血压病史、帕金森病史10余年,血压控制良好。 治疗经过 2022年9月 局部消融治疗 ▪ 2022-09-05:胸腹部CT提示左肺癌切除术后,右肺下叶背段新发结节明显增大,考虑转移。 ▪ 2022-09-16:行右肺结节穿刺活检,病理提示:低分化鳞状细胞癌。 图 患者2022-09-05胸部CT影像与2022-09-16病理诊断 ▪ 2022-09-19:患者家属拒绝全身系统治疗,同意行右肺下叶病灶微波消融术。术后完善基因检测,未见意义突变。 ▪ 2022-09-22:行胸部CT:右肺下叶病灶微波消融术后改变,右侧气胸。 图 患者2022-09-05与2022-09-22胸部CT影像对比 ▪ 2022-10-09:消融术后PET-CT:肺癌术后及射频消融治疗后改变,两肺未见明显代谢活性增高灶;双侧颞叶脑缺血改变(软化灶);双侧颈部多发淋巴结,部分代谢稍高,考虑炎性增生;多发肝囊肿、左肾上腺钙化灶、胰体部稍低密度小结节;肠系膜多发微小结节,代谢不高;结肠代谢活性弥漫性增高;前列腺增生钙化、脊柱退行性改变、左髂骨骨岛。 图 患者2022-10-09 PET-CT影像 2023年7月 局部消融治疗 ▪ 2023-07-06:胸腹部CT提示左肺癌切除术后,右肺结节消融术后,较前增大,考虑恶性肿瘤。 图 患者2023-07-06胸部CT影像 ▪ 2023-07-15:再次行右肺结节穿刺活检,病理提示:(右肺结节)鳞状细胞癌。 ▪ 2023-07-17:再次行右肺病灶微波消融术。 图 患者右肺病灶消融术后CT影像 2024年1-4月 信迪利单抗+安罗替尼治疗 ▪ 2024-01-04:胸部CT提示:右肺下叶病灶较前明显增大。 ▪ 2024-01-10:超声支气管镜检查:右肺下叶基底段开口管腔低回声,行EBUS。 ▪ 2024-01-12:病理检测:鳞状细胞癌。 图 患者2024-01-04胸部CT影像 ▪ 2024年1月16日至2024年4月:患者家属拒绝化疗,同意行信迪利单抗(200mg,d1,q3w)+安罗替尼(10mg,d1-14,q3w),期间疗效评价为SD。 2024年5-7月 放疗+重组人粒细胞巨噬细胞刺激因子+白介素-2+恩沃利单抗治疗 ▪ 2024-05-18:胸腹部CT提示:右肺下叶肺门旁占位较前增大,肝左叶稍低密度影较前新出现,考虑转移可能,纵隔及右肺门稍大淋巴结。 ▪2024-05-29:参与入组布拉格7.0临床研究,行右肺病灶放疗(DT 15Gy/3F)+重组人粒细胞巨噬细胞刺激因子+白介素-2+恩沃利单抗。 图 患者2024-05-18胸腹部CT影像 2024年7月至今 依沃西单抗治疗 ▪ 2024-07-23:胸腹部CT提示:右肺下叶肿块较前稍缩小,两肺多发小结节,转移可能,肝左叶多发低密度影较前增大增多,考虑转移,纵隔及右肺门肿大淋巴结,部分较前增大,转移可能。放疗区域病灶明显缩小,但全身疗效评价PD。 图 患者2024-05-18与2024-07-23胸腹部CT影像对比 ▪ 2024年7月24日起行7周期单药治疗:依沃西单抗(700mg,d1,q3w)。 ▪ 2024-09-26复查胸腹部CT提示:对比2024-07-23检查,右肺下叶肿块、两肺转移灶、肝左叶转移灶、纵膈及右肺门转移淋巴结均较前缩小,疗效评价为PR。 ▪ 2025-04复查胸腹部CT提示:疗效评价为持续PR。目前患者PFS已接近一年,且仍在持续接受依沃西单抗治疗。 图 患者2024-07、2024-09、2025-01以及2025-04胸腹部CT影像对比 病例小结 该病例为一名老年男性患者,于2018年1月确诊为左肺鳞癌,并接受了手术切除治疗。术后,患者拒绝接受辅助治疗。2022年9月,患者右肺下叶出现转移病灶,家属拒绝全身治疗,遂行右肺下叶病灶微波消融术治疗,治疗后复查PET-CT提示代谢活性消失。次年7月,影像学检查显示病灶较前增大,提示疾病进展,因此再次对右肺病灶实施微波消融术。2024年1月,患者病灶再次增大,于2024年1月至2024年4月,给予信迪利单抗联合安罗替尼治疗共5个周期,期间患者病情持续处于疾病稳定(SD)状态。然而,2024年5月,患者肺部病灶再次进展,并疑似出现肝转移。基于此情况,入组布拉格7.0临床研究,采用右肺病灶大分割放疗联合重组人粒细胞巨噬细胞刺激因子、白介素-2以及恩沃利单抗的综合治疗方案。治疗后,患者右肺下叶病灶得到较好控制,但双肺疑似出现多发转移,且肝左叶病灶较前增大并增多。鉴于上述病情变化,2024年7月24日,将治疗方案调整为依沃西单抗单药治疗。治疗后,患者右肺下叶病灶及全身多发转移病灶均较前明显缩小。患者疗效持续PR,且目前仍在持续接受依沃西单抗治疗。 图 病例小结 病例点评 肺腺癌和肺鳞癌是NSCLC中最常见的病理亚型。研究表明,肺鳞癌多病变机制通常更为复杂,患者临床预后较肺腺癌患者更差[7-9]。此外,既往相关研究显示,相较于肺腺癌,肺鳞癌患者对化疗的治疗反应更差,可靶向驱动基因的发生率更低,因此,肺鳞癌患者的治疗选择亦相对有限[10-13]。免疫治疗的出现为晚期NSCLC患者带来了持久的临床获益,并打破了病理组织类型对抗肿瘤治疗效果的限制。多项III期临床研究证实,PD-1/PD-L1抑制剂可显著改善驱动基因阴性晚期NSCLC患者的生存。然而,单一作用机制的免疫治疗方案在肺鳞癌中的疗效已逐渐达到瓶颈,未能完全满足临床需求。因此,亟需探索新型治疗药物或联合治疗策略以进一步改善肺鳞癌患者的预后。 依沃西单抗作为一种抗PD-1/VEGF双特异性抗体,可通过全新机制发挥抗肿瘤作用。根据此前AK112-201和HARMONi-2研究的数据,已成功验证依沃西单抗在晚期驱动基因阴性NSCLC患者中的临床疗效,无论NSCLC患者的病理类型为鳞状或非鳞状,均可获得一致的临床获益,且无论是依沃西单抗单药或依沃西单抗联合化疗均可成为患者重要的治疗选择[6-8]。HARMONi-6研究取得的阳性结果则进一步证实,依沃西单抗可作为肺鳞癌患者更具优势的治疗选择。 图 HARMONi-2研究IRRC评估全人群及关键亚组患者PFS数据 (左右滑动查看更多) 此外,《晚期非小细胞肺癌抗血管生成药物治疗中国专家共识(2022版)》指出,以下情况可能增加出血/咯血风险,在使用抗血管生成药物时需谨慎:伴有空洞或中央型肺鳞癌、长期或大剂量接受抗风湿/抗炎药物或抗凝治疗、原发病灶较大且接受过放射治疗、既往有动脉硬化症病史、存在消化性溃疡等[14]。而HARMONi-2研究中,依沃西单抗组患者则展现出了与对照组患者相似的治疗相关不良事件(TRAE)发生率。更为重要的是,HARMONi-6研究在纳入了约63%的中央型鳞癌患者的前提下,依沃西单抗组患者依旧表现出了与对照组相似并且可控的安全性特征,打破了传统观念中对肺鳞癌患者使用抗血管药物的限制。 图 HARMONi-2研究TRAE发生情况 从此例患者的临床治疗过程中可以看出,患者接受“信迪利单抗+安罗替尼”治疗后很快进展,随后尝试“右肺病灶放疗+重组人粒细胞巨噬细胞刺激因子+白介素-2+恩沃利单抗”的“布拉格治疗方案”,但仍然在患者肺部病灶控制方面作用有限。而患者在先后接受PD-1抑制剂与PD-L1抑制剂联合治疗方案后,依沃西单抗仍为其带来了更为卓越的生存获益。截至目前,患者PFS已接近一年,依沃西单抗也成为了患者自2022年9月疾病进展以来为其带来最为明显生存获益的治疗方案,且治疗过程中未出现明显的TRAE。该患者不仅验证了此前研究中依沃西单抗在肺鳞癌患者中的优势,也侧面证明了依沃西单抗这一抗PD-1/VEGF双特异性抗体与传统靶免联合用药方案具有本质区别。 在临床实践中,针对拒绝化疗或不耐受化疗的晚期肺鳞癌患者,目前尚缺乏有效的标准治疗方案。基于依沃西单抗既往研究数据及其在实际病例中的临床表现,依沃西单抗为患者提供“无化疗(Chemo-free)”的替代方案,从而为无法接受化疗的患者带来更优的治疗选择,这也将为肺癌领域的临床研究与实践提供更多探索启示与方向。此外,该患者治疗过程中所采用的“布拉格治疗方案”可通过放疗诱导肿瘤抗原暴露,GM-CSF促进抗原呈递细胞的激活与增殖,以及PD-1抑制剂激活特异性CD8+T淋巴细胞的杀瘤能力,实现协同增效,从而可有效激发肿瘤免疫应答。该方案不仅突破了放射治疗仅限于局部控制的传统瓶颈,还实现了放射远隔效应从量变到质变的飞跃,这亦将有望成为临床中又一极具临床应用前景的治疗方案[15]。 可以预见的是,随着临床研究的不断深入,将会有更多类似依沃西单抗和“布拉格疗法”的新型抗肿瘤药物或治疗方案被开发出来。这不仅能够惠及更多类型的患者,还将为具有不同特殊治疗需求的患者提供更为优化的治疗选择。 病例分享专家 姚伟荣 教授 江西省人民医院肿瘤科主任,主任医师,博士,硕士研究生导师,2016年入选江西省百千万人才工程。2017年在德国研修肿瘤精确放疗。主要研究方向为肿瘤精确放疗、个体化化疗及免疫靶向治疗。 中国医师协会肿瘤多学科诊疗分会委员 中国医师协会肿瘤医师分会青年委员 中国肿瘤放射治疗联盟放射免疫工作委员会副主委 江西省保健学会肿瘤学分会主任委员 江西省医师协会放射肿瘤治疗医师分会副主任委员 江西省医师协会肿瘤多学科诊疗分会副主任委员 江西省医学会肿瘤学分会副主任委员 江西省医学会肿瘤内科分会副主任委员 江西省抗癌协会常务理事 江西省抗癌协会肿瘤热疗专委会主任委员 病例点评专家: 张力元 教授 苏州大学附属第二医院(核工业总医院)主任医师/教授/博导 苏州大学附属第二医院(核工业总医院)副院长 苏州市政协医药卫生组副组长 中国肿瘤放射治疗联盟放射免疫工作委员会副主任委员 中国肿瘤放射治疗联盟放射免疫青年工作委员会主任委员 中国研究型医院学会2023、2024年度“研究型人才” 江苏省研究型医院学会肿瘤放疗分会候任主任委员 江苏省免疫学会放射与免疫专委会首任主任委员 江苏省医学重点人才 江苏省“333”人才(第二层次) 主持4项国自然基金项目 苏州市魅力科技人物 苏州市卫生领军人才 参考文献: [1] 中国临床肿瘤学会(CSCO)非小细胞肺癌诊疗指南 2025. [2] Paz-Ares L, Luft A, Vicente D, et al. Pembrolizumab plus Chemotherapy for Squamous Non-Small-Cell Lung Cancer[J]. N Engl J Med. 2018, 379(21):2040-2051. [3] Ren S, Chen J, Xu X, et al. Camrelizumab Plus Carboplatin and Paclitaxel as First-Line Treatment for Advanced Squamous NSCLC (CameL-Sq): A Phase 3 Trial[J]. J Thorac Oncol. 2022, 17(4):544-557. [4] Zhao Y, Chen G, Chen J, et al. AK112, a novel PD-1/VEGF bispecific antibody, in combination with chemotherapy in patients with advanced non-small cell lung cancer (NSCLC): an open-label, multicenter, phase II trial[J]. EClinicalMedicine. 2023, 62:102106. [5] Z. Li, et al. Phase II results of ivonescimab (ivo) a novel PD-1/VEGF bispecific in combination with chemotherapy for first-line treatment of patients (pts) with advanced/metastatic squamous (Sq) non-small cell lung cancer (NSCLC). 2024 ELCC, 68P. [6] Yuangyuan Zhao, et al. A phase II study of AK112 (PD-1/VEGF bispecific) in combination with chemotherapy in patients with advanced non-small cell lung cancer. 2022 ASCO, 9019. [7] Yu H, Chen Z, Ballman KV,et al. Correlation of PD-L1 Expression with Tumor Mutation Burden and Gene Signatures for Prognosis in Early-Stage Squamous Cell Lung Carcinoma[J]. J Thorac Oncol. 2019, 14(1):25-36. [8] Gómez-López S, Whiteman ZE, Janes SM. Mapping lung squamous cell carcinoma pathogenesis through in vitro and in vivo models[J]. Commun Biol. 2021, 4(1):937. [9] Rahal Z, El Nemr S, Sinjab A, et al. Smoking and Lung Cancer: A Geo-Regional Perspective[J]. Front Oncol. 2017, 7:194. [10] Scagliotti GV, Parikh P, von Pawel J, et al. Phase III study comparing cisplatin plus gemcitabine with cisplatin plus pemetrexed in chemotherapy-naive patients with advanced-stage non-small-cell lung cancer[J]. J Clin Oncol. 2008, 26(21):3543-51. [11] Santos ES, Rodriguez E. Treatment Considerations for Patients With Advanced Squamous Cell Carcinoma of the Lung[J]. Clin Lung Cancer. 2022, 23(6):457-466. [12] Adib E, Nassar AH, Abou Alaiwi S, et al. Variation in targetable genomic alterations in non-small cell lung cancer by genetic ancestry, sex, smoking history, and histology[J]. Genome Med. 2022, 14(1):39. [13] Lewis WE, Hong L, Mott FE, et al. Efficacy of Targeted Inhibitors in Metastatic Lung Squamous Cell Carcinoma With EGFR or ALK Alterations[J]. JTO Clin Res Rep. 2021, 2(11):100237. [14] 中国临床肿瘤学会血管靶向治疗专家委员会,中国临床肿瘤学会非小细胞肺癌专家委员会,中国临床肿瘤学会非小细胞肺癌抗血管生成药物治疗专家组. 晚期非小细胞肺癌抗血管生成药物治疗中国专家共识(2022版). 中华医学杂志,2022,102(48):3819-3835. [15] 徐美玲, 张辰阳, 邢鹏飞, 等. “布拉格治疗”PD-1及PD-L1抑制剂耐药的晚期难治性非小细胞肺癌1例 [J] . 中华医学杂志, 2023, 103(44) : 3584-3586.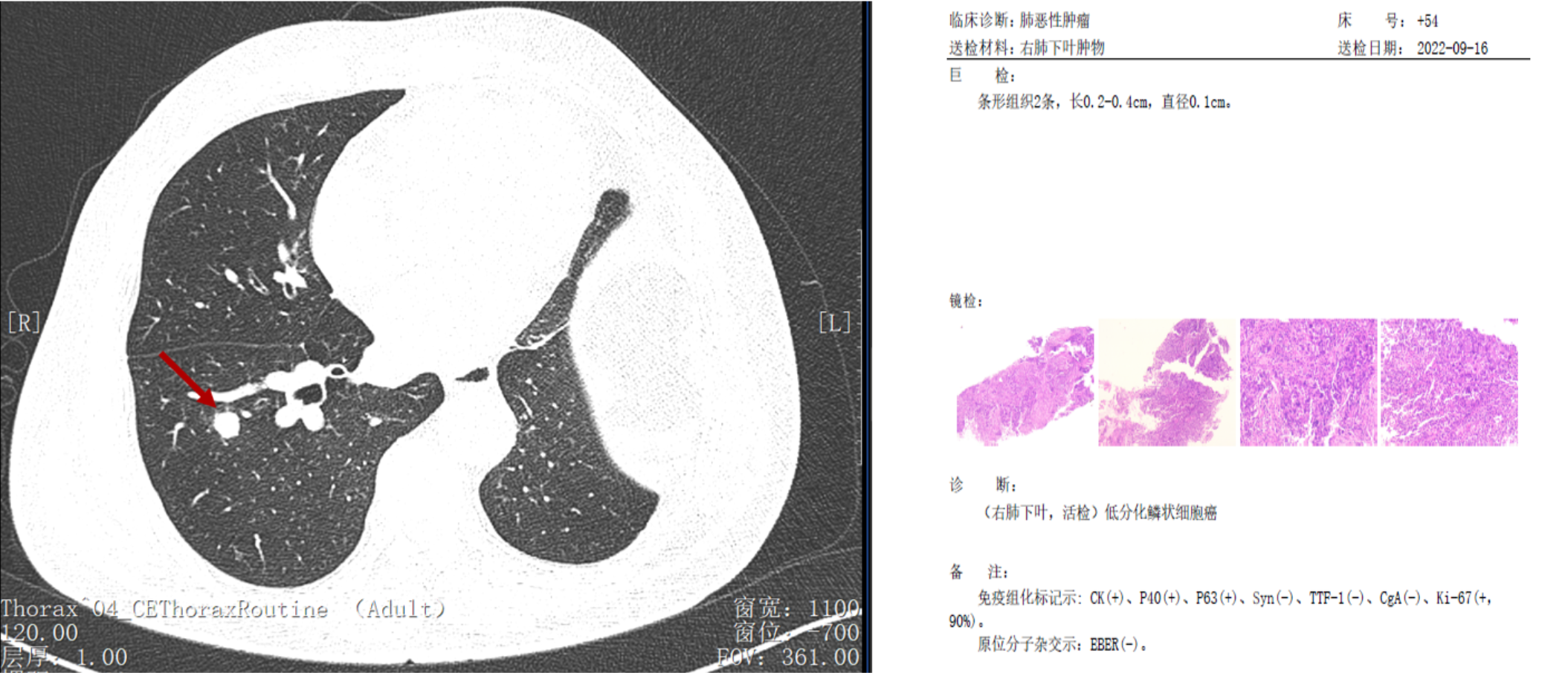
3