稚嫩生命遇CMV难关?马立巴韦破药物匮乏困局、助患者重获新生。记一例肺移植后CMV患者治疗经过
医脉通 2025.12.03

星聚医线 抑之有道
34条内容
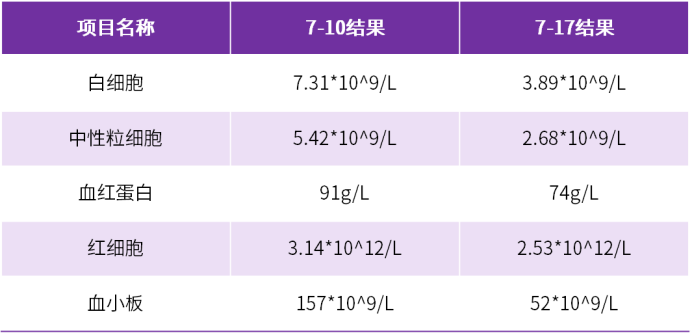
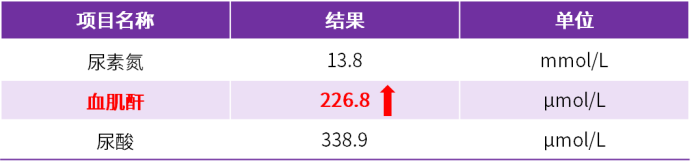
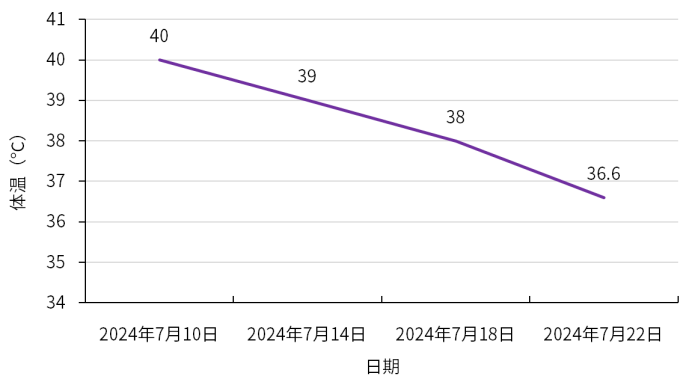
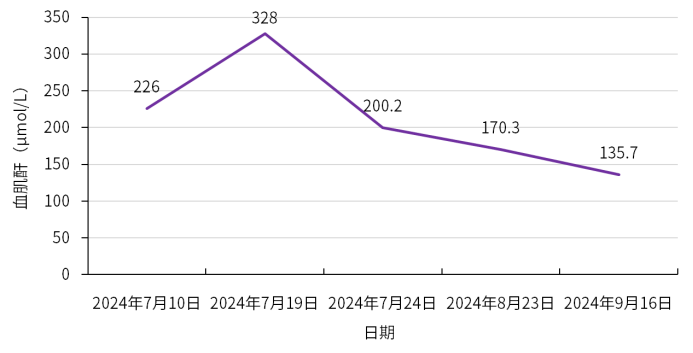
4月余体外膜肺氧合(ECMO)坚守,12岁以上的儿童患者终获双肺移植的新生契机,然而,移植后却出现巨细胞病毒(CMV)综合征,更伴随肾损伤与骨髓抑制的多重考验。在无药可用的困境下,这份沉甸甸的治疗成果,怎样才能牢牢守护,不让稚嫩生命被病魔吞噬?本期,医脉通特邀无锡市人民医院吴波教授、姜淑云教授、杨航教授基于该患者治疗经过分享肺移植后CMV治疗策略,以飨读者。 2023年8月:患者因ARDS、呼吸衰竭、重症肺炎(细菌合并真菌感染)、胸腔积液、气胸、轻度肺动脉高压、心功能不全,伴凝血功能异常、中性粒细胞减少症、中度贫血、血小板减少入院,在当地医院治疗后无改善,胸部CT示两肺实变,予静脉-静脉体外膜肺氧合(VV-ECMO)治疗;但肺部情况仍无法逆转,遂至我院寻求肺移植术。 2023年12月18日:VV-ECMO治疗4月余,患者接受双肺移植术。术后,予环孢素、甲泼尼龙免疫抑制,头孢他啶-阿维巴坦、氨曲南等抗细菌,艾沙康唑等抗真菌,更昔洛韦预防CMV等治疗,病情逐渐得到控制。 2023年12月20日:患者发生急性肾损伤,予连续性肾脏替代治疗(CRRT),初始连续治疗,后续调整为间断治疗,2024年7月2日停用CRRT; 2024年3月17日-6月14日:因患者中性粒细胞计数降低,停用更昔洛韦(疗程3月),予来特莫韦预防CMV感染(疗程3月)(图1); 图1.CMV预防治疗及CRRT治疗 2024年7月8日:患者血肌酐再次升高。 2024年7月10日:患者出现发热症状(40℃),CMV-DNA 939copies/mL,结合既往血常规结果,并继续动态监测血常规,提示白细胞、血红蛋白、血小板三系均有降低趋势(表1),血肌酐升高(表2),提示存在肾损伤。 表1.血常规检查结果 表2.肾功能生化检查结果 (上下滑动以查看更多内容) 基础状况较差的情况下,如何制定CMV治疗方案? 治疗难点 1.术后早期即积极预防CMV处理,疗程足够长(更昔洛韦3月+来特莫韦3月),但仍出现CMV综合征; 2.肾损伤持续进展:患者术后早期即发生急性肾损伤,肾功能本就脆弱,7月8日血肌酐升高,提示再次发生肾损伤,给CMV治疗药物选择带来限制; 3.血象全面偏低且呈下降趋势:确诊CMV综合征时,血红蛋白已偏低,而白细胞及血小板计数亦呈现下降趋势,整体血象较差,增加了感染控制难度与并发症风险。 治疗决策 1. 破局要点:CMV治疗药物选择应以“有效控感染、低骨髓抑制、低肾损伤”为核心,优先选用抗CMV活性明确、对造血功能影响小、肾毒性低且适配肾损伤患者的药物,规避骨髓抑制及肾损伤风险较高的药物,兼顾儿童耐受性,在控感染的同时保护骨髓与肾功能。 2. 精准赋能:SOLSTICE研究显示,与常规抗病毒药物相比,马立巴韦治疗后CMV血症转阴率更高(55.7% vs 23.9%,P<0.001),转阴中位时间更短(22天vs 27天,P=0.04),在停药后第8周实现病毒清除且症状控制的患者比例更高,随访期观察到的临床复发率更低,且骨髓抑制及肾毒性风险更低,可用于存在轻中重度肾损伤的CMV感染患者,无需调整剂量1,2。 2024年7月13日:考虑到患者肾功能损伤及血象状况,CMV感染3天后予马立巴韦治疗; 2024年7月24日:治疗10天后,患者CMV-DNA检测阴性,体温恢复正常(图2),血肌酐明显降低; 图2.患者接受马立巴韦治疗前后体温变化 2024年9月7日:马立巴韦治疗八周后停药; 2024年9月10日-16日:复查提示CMV维持阴性状态,血肌酐持续降低(图3)。 图3.患者接受马立巴韦治疗前后血肌酐变化 姜淑云教授 无锡市人民医院 杨航教授 无锡市人民医院 本案例中,患者在长程ECMO辅助支持下成功接受双肺移植,但完成移植并非终点,移植后的感染威胁仍是临床和患者需共同迈过的难关,而本例患者在充分预防CMV的基础上出现感染,治疗用药选择十分局限,此外,肾损伤与骨髓抑制亦给CMV感染治疗带来了极大挑战。基于此,遵循“有效控感染、低骨髓抑制、低肾损伤”原则,选用马立巴韦进行治疗。治疗10天后,患者CMV转阴,体温恢复正常,血肌酐持续降低,表明马立巴韦抗CMV效果显著,也提示存在骨髓抑制或肾功能损伤、无法耐受传统抗CMV治疗的患者可以考虑一线应用马立巴韦治疗。 此外,本例患者经马立巴韦治疗8周后停药,复查示CMV持续维持阴性。结合本例患者成功经验及既往治疗案例,建议有条件的患者应接受马立巴韦8周足疗程治疗,原因在于: CMV感染是慢性移植肺功能障碍(CLAD)的高危因素,然而,目前CLAD治疗药物及疗效有限,二次移植代价极高,有效抗感染并预防复发至关重要; 由于CMV治疗选择局限,马立巴韦是CMV治疗最后一道关卡,耐药后治疗空间极窄,需把握单次治疗机会; 马立巴韦8周治疗周期获益得到临床充分验证; 马立巴韦骨髓抑制及肾毒性风险低,安全性良好; 目前,马立巴韦已纳入国家医保目录,药物可及性提高,患者治疗负担明显减轻。 基于马立巴韦8周治疗周期的必要性及可行性,建议有条件的患者足疗程治疗以最大程度降低复发风险、保障治疗效果。 吴波教授 无锡市人民医院 CMV感染是移植后常见的病毒感染之一,儿童肺移植患者移植后第一年内血液中检出CMV的比例为29%–32%3。CMV感染作为影响移植物与患者长期存活的关键风险因素,可增加肺移植患者死亡和二次移植风险,并导致移植物功能障碍和丢失4,5。值得注意的是,近年来,我国儿童肺移植手术量呈逐年上升趋势6,表明CMV感染的防控与规范治疗已成为临床亟待解决的关键课题。 目前,儿童CMV感染后治疗药物选择有限。马立巴韦作为中国目前唯一获批用于移植后难治性/耐药性CMV感染或疾病的药物,其在成人患者中的治疗获益已经获得充分验证。而本案例作为较早将马立巴韦应用于儿童患者中的病例,其成功的治疗结局,可为本中心乃至其他中心儿童CMV治疗提供参考,尤其针对合并肾损伤、骨髓抑制的复杂病例,马立巴韦是安全、有效实现CMV快速转阴的重要治疗选择。 近期,马立巴韦已获批用于治疗造血干细胞移植或实体器官移植后CMV感染和/或疾病,且对一种或多种既往治疗(更昔洛韦、缬更昔洛韦、西多福韦或膦甲酸钠)难治(伴或不伴基因型耐药)的儿童患者。期待随着马立巴韦的进一步广泛应用,可为更多稚嫩生命的长期健康保驾护航! 姜淑云 教授 南京医科大学附属无锡人民医院 ICU 副主任医师 江苏省医师协会器官移植分会委员 长期从事心肺手术术后重症监护一线工作,擅长心脏手术、肺移植手术的围手术期管理及ECMO、IABP、CRRT的管理,对各种急危重症尤其是ARDS、脓毒血症等患者的救治经验丰富 杨航 教授 无锡市人民医院肺移植中心 副主任医师 中国康复医学会器官移植康复专业委员会儿童器官移植康复学组委员 中国医学装备协会呼吸病学装备专委会呼吸支持学组委员 江苏省免疫学会转化医学专委会委员 无锡市感染病学分会委员 以主要完成人获2020年华夏医学科技奖一等奖、2023年江苏省科技进步奖一等奖 在SCI、核心期刊发表文章10篇 吴波 教授 呼吸与危重症医学科主任医师 南京医科大学硕士研究生导师 江苏省肺移植中心副主任 无锡市人民医院肺移植科副主任 国家人体器官分配与共享计算机系统科学委员会委员 中国肺移植质控中心专家组成员 中华医学会器官移植分会肺移植学组副组长 国家心血管病学会第二届右心与肺血管病专委会委员 中国康复医学会呼吸康复专业委员会委员 第六届国之名医 加拿大多伦多总医院肺移植项目和美国 UCSD 肺科中心访问学者 擅长肺移植围术 期管理、危重肺动脉高压抢救、呼衰抢救、 支气管镜介入和右心导管技术 参考文献 1. Avery RK, et al. Clin Infect Dis. 2022 sep 10;75(4):690-701. 2. 马立巴韦说明书. 3. Kotton CN, et al. Transplantation. 2018 Jun;102(6):900-931. 4. Almaghrabi RS, et al. Expert Rev Respir Med. 2017 May;11(5):377-383. 5. Danziger-Isakov LA, et al. Transplantation. 2003 May 15;75(9):1538-43. 6. Li XS, et al. World J Pediatr. 2025 Jun;21(6):597-612. 此病例由杨航教授提供,已征得患者同意 原创内容,未经许可不得转载 仅供医疗卫生专业人士为了解资讯使用。该等信息不能以任何方式取代专业的医疗指导,也不应视为诊疗建议。如该等信息被用于了解资讯以外的目的,本站及武田不承担相关责任。