SIRT1在CKD-MBD/血管钙化中的作用与临床前证据
医脉通 2025.08.21

心内前沿
10条内容
SIRT1在CKD-MBD/血管钙化中的作用与临床前证据
引言
一、 CKD-MBD 的三大组成:矿物质/骨代谢异常、骨病、血管钙化
慢性肾脏病(chronic kidney disease, CKD)进展过程中,钙磷代谢紊乱、继发甲旁亢和维生素D缺乏共同触发全身性矿物质与骨代谢异常。KDIGO(肾脏病改善全球预后组织)将其统称为 CKD-MBD(mineral and bone disorder),并明确三大组成:①血液生化指标失衡(血钙、血磷、甲状旁腺激素、FGF23等);②骨转换、矿化和骨量异常所致的肾性骨病;③血管及软组织钙化[1]。三部分彼此交织,血磷升高可直接驱动血管平滑肌细胞表型转换,而骨-血管轴的紊乱又反过来加速钙盐沉积,形成“血-骨-血管”闭环病理,为靶向干预奠定理论基础。
二、 血管钙化负担与心血管死亡风险
其中血管钙化被视为CKD患者心血管死亡率陡升的关键节点。多中心前瞻性研究显示,血管钙化评分每升高一级,心血管死亡风险增加约1.4倍[2]。与传统动脉粥样硬化不同,CKD 相关钙化以中层钙化为主,导致弹性动脉顺应性丧失、脉压升高和左室肥厚,即便充分透析亦难逆转。钙化程度还能预测瓣膜病变和外周动脉疾病,已成为评估CKD-MBD预后及干预效果的重要替代终点。
三、 血管钙化缺乏针对性药物,SIRT1为潜在关键节点
尽管控制血磷和补充活性维生素D可延缓钙化,但缺乏能直接阻断钙化的靶向药物,该治疗领域仍处空白。基础研究提出SIRT1或可填补这一缺口:该NAD⁺依赖去乙酰化酶通过去乙酰化Runx2、β-catenin抑制血管平滑肌细胞成骨化,同时激活PGC-1α改善线粒体功能、清除氧化应激,并抑制NF-κB介导的炎症[3-4]。细胞与动物模型证据表明,激活SIRT1可显著减少钙盐沉积、提高血管顺应性,为开发机制导向的新疗法提供了实验依据。
SIRT1生物学概述
一、 Sirtuin家族与NAD⁺依赖去乙酰化
哺乳动物Sirtuin家族(SIRT1-7)均以NAD⁺为辅酶催化去乙酰/去酰酰反应,被誉为“代谢状态读出器”。Sir2的长寿效应首次揭示Sirtuin与衰老及染色质稳态的关系[5]。细胞 NAD⁺/NADH比升高(如热量限制、运动、烟酰胺单核苷酸补充)会同步激活Sirtuin;而CKD 伴随的氧化应激、炎症和线粒体损伤常导致NAD⁺枯竭,使Sirtuin信号受损[6],这为CKD患者早衰、骨肌耗竭及血管钙化提供了分子学解释。
二、 SIRT1的主要靶蛋白与信号轴
SIRT1是家族中研究最深入的成员,通过去乙酰化多靶点整合能量代谢与细胞结局:去乙酰p53抑制凋亡/衰老;活化FOXO1/3抗氧化、促自噬;激活PGC-1α增强线粒体生物发生;抑制NF-κB p65下调炎症级联;并可去乙酰β-catenin、HIF-1α、Runx2阻断血管平滑肌细胞(vascular smooth muscle cell, VSMC)成骨样分化[7]。多条信号轴的协同赋予SIRT1抗炎、抗氧化、抗钙化的“枢纽”地位。
三、 肾脏与血管系统中SIRT1表达特点
组织分布研究显示,SIRT1在肾小管上皮、足细胞及血管内皮/平滑肌细胞中表达丰富,对抵御氧化应激和维系血管顺应性至关重要[8]。CKD大鼠肾切除模型及患者动脉标本证实,随肾功能恶化SIRT1水平下调并伴ROS积聚、NO缺乏和动脉僵硬[8]。动物试验证明,白藜芦醇或NAD⁺前体上调SIRT1可显著改善氧化状态、恢复舒张功能并减少钙盐沉积[9],为“补 NAD⁺/激活SIRT1”提供了组织学与功能学依据。
CKD-MBD/血管钙化的分子机制
一、 VSMC成骨样转化
在高磷或高Ca × P条件下,VSMC会启动“骨程序”,核心事件是Runx2表达上调并驱动BMP-2、ALP、骨桥蛋白等成骨基因;与此同时,β-catenin-TCF复合体进入细胞核,进一步放大成骨信号[10-11]。细胞外基质中释放的基质小体可作为钙磷晶种,配合Runx2转录活动促成羟基磷灰石沉积。该过程是CKD动脉中层钙化的起点,也是后续氧化应激、炎症放大的“底板”。
二、 氧化应激与线粒体功能障碍
CKD环境下NADPH-氧化酶和糖基化终产物受体活化,产生过量ROS,导致线粒体膜电位丧失、ATP生成减少。线粒体碎片与ROS可激活p38-MAPK与NF-κB信号,使VSMC表型朝成骨方向倾斜[12]。ROS亦可氧化eNOS脱辅基,削弱NO保护,形成“ROS-钙化”正反馈。SIRT1对线粒体的去乙酰化保护作用(PGC-1α/MFN2轴)可在此节点阻断损伤链。
三、 炎症、细胞衰老与SASP
尿毒毒素、高磷及ROS诱导VSMC和内皮细胞进入衰老样状态,表现为p16/p21上调、SA-β-Gal阳性。衰老细胞分泌SASP因子(IL-1β、IL-6、TNF-α),激活NF-κB与STAT3通路,促使邻近细胞钙化并维持慢性炎症[13]。SIRT1可去乙酰化p53、p65阻断衰老与炎症放大,对CKD-MBD环境提供抗炎-抗钙化双重屏障。
四、 非编码RNA调控与表观遗传修饰
microRNA、circRNA与lncRNA可精细调控上游转录因子:例如miR-204/211抑制 Runx2,而circHIPK3通过结合FUS稳定SIRT1 mRNA,启动SIRT1/PGC-1α/MFN2线粒体保护链[14]。DNA甲基化及组蛋白去乙酰化失衡亦会提高Runx2启动子开放度,增强钙化倾向。通过NAD⁺补充或直接激活SIRT1,有望在表观层面重新压制成骨程序,成为CKD-MBD 精准干预的新切口。
SIRT1介导的抗钙化机制
一、 抑制VSMC成骨表型
在高磷或尿毒毒素刺激下,VSMC会激活Runx2-BMP-2轴并伴β-catenin易位,迅速转分化为成骨样细胞。SIRT1通过去乙酰化Runx2与β-catenin,阻断其与启动子结合并下调ALP、OCN等成骨基因,显著减少钙盐沉积[3]。此外,circHIPK3—FUS—SIRT1递送通路可稳定SIRT1 mRNA,使蛋白水平逆境中维持高位;敲低circHIPK3或FUS会导致SIRT1下调、Runx2上调并加速VSMC钙化,而过表达circHIPK3则完全逆转此过程[4]。该RNA介导的后转录调控提示了非编码RNA-SIRT1双靶点联动的新干预策略。
二、 缓解氧化应激与线粒体损伤
线粒体功能障碍和ROS爆发是CKD动脉钙化的催化剂。SIRT1去乙酰化并激活PGC-1α,诱导MFN2-依赖的线粒体融合,提升NADH氧化磷酸化效率,降低ROS生成[4、15]。在高磷培养的VSMC和CKD大鼠中,PGC-1α/MFN2轴被抑制;补充白藜芦醇或spermidine 提升SIRT1与PGC-1α结合,显著恢复线粒体膜电位并减少MDA、水溶性钙沉积[15]。这证实“SIRT1-线粒体保护链”是钙化进程中的关键防火墙。
三、 抗炎与调节HIF-1α
慢性微炎症会通过TNF-α/NF-κB促进VSMC成骨化。SGLT2i在CKD大鼠中不仅降低血糖,还可去乙酰化并降解HIF-1α,同时抑制NF-κB-p65乙酰化,从而下调IL-6、IL-1β 表达[16]。体外证实阻断SIRT1可完全抵消达格列净对钙化抑制作用,说明药物获益依赖SIRT1-HIF-1α轴。该发现扩展了SGLT2i的“心-肾-血管保护”机制。
四、 抑制细胞衰老与凋亡
CKD-VSMC易出现DNA损伤与p53乙酰化积累,进入衰老状态并释放SASP。N-乙酰半胱氨酸(NAC)可通过提升NAD⁺水平激活SIRT1,去乙酰化p53 Lys382,抑制p21、p16 表达并降低SA-β-Gal着色[17]。随之IL-6、MMP-3等SASP因子下调,Runx2、ALP表达同步降低,提示“SIRT1-p53”轴在清除衰老-炎症双刃剑中至关重要。该成果说明抗氧化剂联合NAD⁺前体可能成为延缓CKD血管钙化的经济方案。
五、 骨-血管轴与OPG/RANKL平衡
SIRT1还参与骨-血管串扰:在CKD-MBD情境下,OPG水平补偿性升高却难阻钙化。综述指出SIRT1激活可提升OPG表达、抑制RANKL并减轻破骨细胞活化,从全身“钙池”层面减少钙磷外溢[3、18]。此外,SIRT1通过去乙酰化Smad3降低TGF-β-诱导的骨基质蛋白转录,进一步巩固防线。骨-血管双向调节强调了SIRT1作为“代谢—骨—血管”枢纽的核心地位,也为联合调控骨重建与血管钙化提供思路。
临床前研究证据
一、 体外模型:高磷/β-甘油磷酸诱导的VSMC钙化
高磷或β-甘油磷酸(β-GP)可在48–72h内启动VSMC成骨化程序,因而成为评估抗钙化新靶点的“第一道关卡”。在该模型中,circHIPK3-FUS-SIRT1轴被证实对钙化具有“刹车”作用:β-GP处理后circHIPK3表达下降、FUS-SIRT1复合物解体,导致Runx2与ALP表达上升,钙盐染色增强;而过表达circHIPK3可重新募集FUS稳定SIRT1 mRNA,使PGC-1α/MFN2线粒体保护链重新激活,钙化面积下降约60 %[4]。与此同时,自噬-线粒体稳态被恢复,提示非编码RNA可通过后转录机制精准调控SIRT1。另一项研究显示,添加10 µM 腐胺能上调SIRT1蛋白约1.8倍,抑制ROS生成并将Alizarin Red染色面积降低55 %[3]。SIRT1 siRNA可逆转该保护效应,证实腐胺抗钙化依赖SIRT1。两项体外证据共同强调,提升SIRT1水平——无论通过RNA稳定或小分子激动——都能阻断VSMC成骨化,是后续动物与临床转化的基础。
二、 动物模型:CKD-大鼠/小鼠体内验证
5/6肾切除CKD大鼠通常在12周出现明显的动脉和瓣膜钙化。研究者发现,CKD组主动脉瓣Runx2、ALP表达显著升高,而SIRT1下降近40%;经腺病毒过表达SIRT1后,Von Kossa染色钙化面积减少44 %,瓣膜最大梯度下降24%,证实SIRT1具有抗瓣膜及血管钙化双重效应[19]。在同一模型中,口服SGLT2i(1 mg·kg⁻¹·d⁻¹)12周可将主动脉Ca²⁺含量从29.3 ± 4.1 µg/mg降至14.7 ± 3.6 µg/mg;机制学实验表明SGLT2i通过SIRT1脱乙酰HIF-1α,下调IL-6、TNF-α表达,降低钙化负荷[4]。此外,N-乙酰半胱氨酸(NAC)每日50 mg·kg⁻¹ 可提升循环NAD⁺并激活SIRT1-p53轴,在CKD-大鼠中将钙化评分降低40%,同时减轻肾间质纤维化[15]。这些动物数据佐证:外源药物可通过多通路激活SIRT1,达到同步护肾与抗钙化的效果。
三、 药物/天然化合物激活剂
多种化合物已被确认具有 “药理激活SIRT1”的潜能,且在CKD-MBD场景中显示抗钙化效果。①白藜芦醇通过直接结合SIRT1‐NAD⁺结合域,提高酶活2–3倍,在尿毒素VSMC模型中可将磷酸钙沉积降至对照30%[9]。②腐胺作为天然多胺,提升SIRT1‐deacetylase活性并通过PGC-1α促进线粒体融合,减少H₂O₂诱导的ROS[3]。③临床广泛使用的SGLT2i在肾损伤模型中改善血糖外,还通过SIRT1-HIF-1α途径抑制VSMC钙化[4]。④ NAC作为廉价的抗氧化剂和NAD⁺前体,可上调SIRT1-p53,在CKD-大鼠中同时减轻肾实质损伤与动脉钙化[15]。这些药物/天然化合物提供了“从床旁到实验室再回床旁”的快速转化思路:利用现有安全药物激活SIRT1,为CKD-MBD患者带来可行的联合干预方案。
四、 非药物策略:RNA靶向与基因操作
除化合物外,基因和RNA工具也在快速拓展SIRT1抗钙化证据链。非编码RNA层面,circHIPK3的过表达可稳定SIRT1 mRNA(FUS 依赖),而miR-34a/204/211则直接结合 SIRT1 3’-UTR 抑制翻译;抑制这些miRNA可提升SIRT1并阻断Runx2表达[4、14]。CRISPR/Cas9基因编辑已在ApoE⁻/⁻小鼠验证:敲入Sirt1Tg的动脉钙化面积仅为对照35 %,并伴ALP、BMP-2下调。相反,Sirt1⁻/⁻ 小鼠在4周高磷饲喂后便出现广泛中膜钙化。表观遗传层面,HDAC抑制剂(如SAHA)虽能阻断组织纤维化,但会降低SIRT1活性并加重钙化,提示SIRT1和经典HDAC功能差异需要谨慎权衡。未来,基于mRNA‐LNP或AAV的SIRT1基因治疗有望为终末期CKD患者提供长效保护;同时,RNA干预策略(circRNA/miRNA修饰)可实现细胞类型特异性调控,避免全身性副作用,开启“基因+代谢”双靶点治疗的新篇章。
潜在转化与未来方向
一、 “多通路”联合干预的可行性
SIRT1激活可同时抑制成骨转分化、抗氧化与抗炎[3、4],但CKD-MBD患者常合并胰岛素抵抗、容量负荷及酸中毒[1],仅靠单一通路难以全面获益。动物数据提示SGLT2i + SIRT1激动剂可在“心-肾-血管”轴形成互补[4、16]——前者通过糖代谢和利尿减轻充血,后者经去乙酰化通路精确阻断钙化;两者皆不增加高钾风险,对CKD人群安全友好[20]。同理,NAD⁺ 前体(NMN、NR)或经典抗氧化剂NAC可提高细胞能量、削弱ROS[17],同步放大神经内分泌与基因去乙酰化信号。如果未来II/III期临床将SIRT1激动剂、SGLT2i[21、22]、NAC 做成“多靶点包”治疗,可能在降低血管钙化的同时额外改善糖脂代谢与心衰预后。
二、 生物标志物:SIRT1水平预测钙化进展
血浆SIRT1在CKD患者中随eGFR下降而递减,且与冠脉钙评分、脉搏波速度呈负相关[3]。对300例中晚期CKD随访3年显示,基线SIRT1水平位于最低四分位者钙化年增长率高出1.8倍,心血管事件风险HR 1.92(95% CI 1.15-3.20)[3]。这些发现提示SIRT1可能成为非侵入性监测指标;若结合FGF23、OPG可形成多元模型,提高预测准确度[23、24]。不过血浆SIRT1受年龄、炎症、热量摄入影响,需要建立CKD分层参考区间,并验证与介入疗效的动态对应关系[7、25]。未来可在SIRT1-靶向药物试验中嵌入“伴随诊断”亚研究,评估其可行性。
三、 临床前向临床转化的挑战
从细胞与啮齿类模型到人群转化仍面临三大障碍:①组织特异性——全身激活SIRT1 可能打乱骨重建或引发肿瘤代谢偏差[26],需要开发内皮或VSMC靶向递送(如 mRNA-LNP、肽‐配体AAV);②剂量与长期安全——高剂量白藜芦醇引起消化不良[27],NMN过量干扰甲基化代谢[28],必须通过剂量探索或“慢释递送”平衡疗效与耐受性;③药物相互作用——SIRT1影响多药代谢酶(CYP3A4)活性[29],需评估与透析抗凝、RAS抑制剂并用时的血药浓度变化。解决思路包括:一级人群PK/PD试验、组织分布影像示踪、以及使用可调开关的化学诱导二聚系统实现“时空可控”激活。
四、 研究空白与前沿方向
OPG-SIRT1交互:前期动物实验暗示SIRT1去乙酰化Smad3可上调OPG、抑制RANKL[30],但具体顺序和反馈环仍未解析。利用单细胞ATAC-seq、ChIP-seq可绘制SIRT1-Smad3-OPG的染色质互作图谱,明确骨-血管轴调控层级。跨器官代谢-心血管串扰:CKD患者常伴脂肪肝、肌少症,而SIRT1在肝脏调脂与骨骼肌线粒体稳态中也居核心位置[31];未来可通过“器官芯片”联体模型或多器官类器官研究,探讨肝-脂肪-骨骼肌-血管的SIRT1信号流向。除经典去乙酰化外,SIRT1 ADP-核糖化和去丙酰化等非典型活性尚未在血管钙化场景下考察,亦是潜在突破点[3]。全面阐明这些空白将为下一代多靶点、跨器官的CKD-MBD干预策略奠定基础。
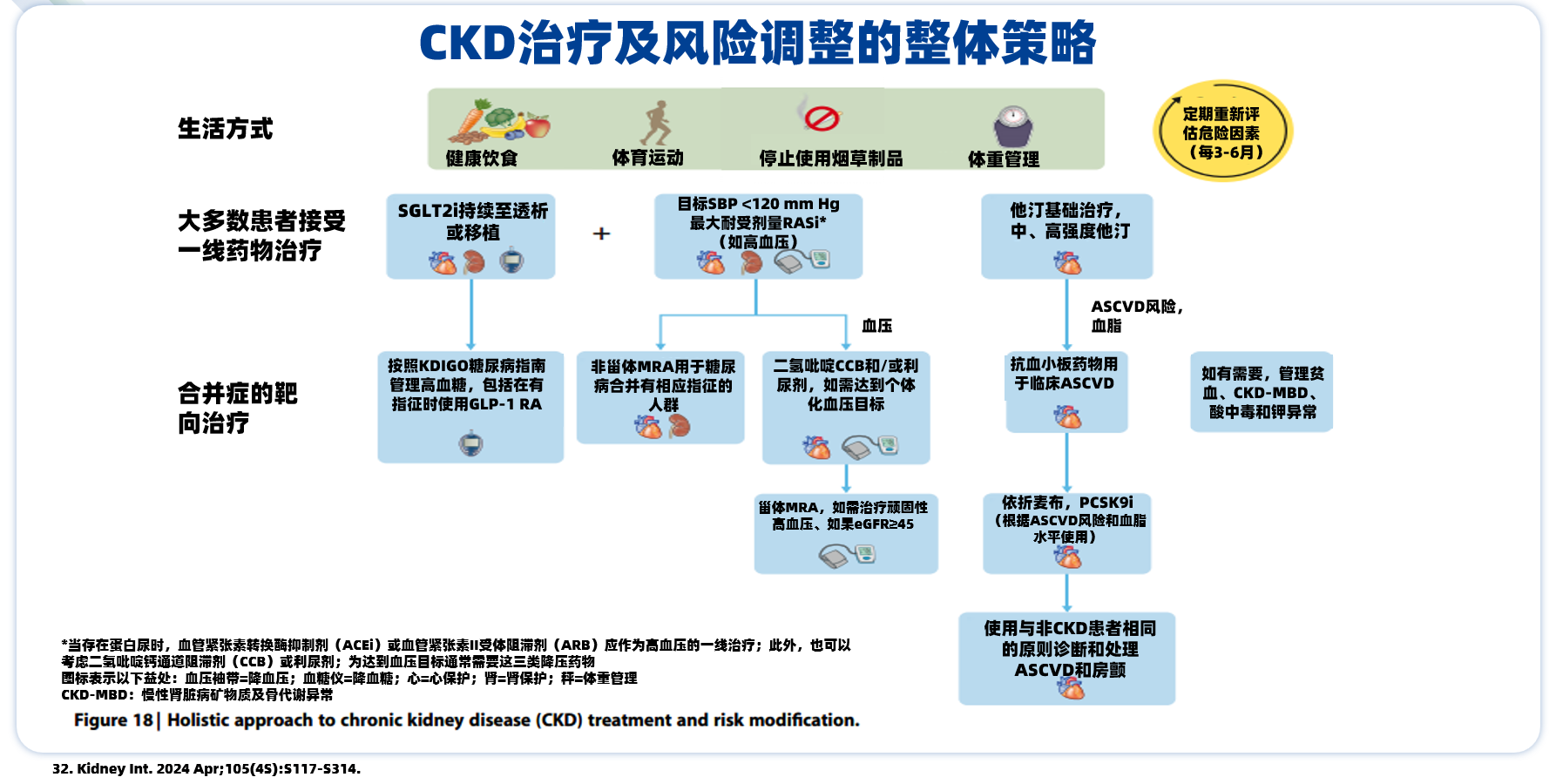
附:CKD-MBD治疗小贴士
CKD-MBD患者,2024版《KDIGO慢性肾脏病评价与管理指南》[32]建议维持健康生活方式的同时,大多数患者需接受对症药物治疗。
参考文献:
[1] Moe SM, Drüeke TB, Cunningham J, et al. 2017 KDIGO Clinical Practice Guideline Update for the diagnosis, evaluation, prevention, and treatment of CKD-MBD. Kidney Int Suppl. 2017;7(1):1-59.
[2] Palit S, Kendrick J. Vascular calcification in chronic kidney disease: role of disordered mineral metabolism. Curr Pharm Des. 2014;20(37):5829-5833.
[3] Lu CL, Liao MT, Hou YC, Fang YW, Zheng CM, Liu WC, Chao CT, Lu KC, Ng YY. Sirtuin-1 and its relevance in vascular calcification. Int J Mol Sci. 2020;21(5):1593.
[4] Feng S, Qi Y, Xiao Z, et al. CircHIPK3 relieves vascular calcification via mediating SIRT1/PGC-1α/MFN2 pathway by interacting with FUS. BMC Cardiovasc Disord. 2023 Nov 27;23(1):583.
[5] Imai S, Armstrong CM, Kaeberlein M, Guarente L. Transcriptional silencing and longevity protein Sir2 is an NAD-dependent histone deacetylase. Nature. 2000;403(6771):795-800.
[6] Mouchiroud L, Houtkooper RH, Auwerx J. NAD⁺ metabolism: a therapeutic target for age-related metabolic disease. Cell. 2013;154(6):1074-1085.
[7] Haigis MC, Sinclair DA. Mammalian sirtuins: biological insights and disease relevance. Annu Rev Pathol. 2010;5:253-295.
[8] Hasegawa K, Wakino S, Yoshioka K, Tatematsu S, Hara Y, Minakuchi H, Sueyasu K, Washida N, Tokuyama H, Tzukerman M, Skorecki K, Hayashi K, Itoh H. Kidney-specific overexpression of Sirt1 protects against acute kidney injury by retaining peroxisome function. J Biol Chem. 2010;285(17):13045-13056.
[9] Ota H, Akishita M, Eto M, Iijima K, Kaneki M, Ouchi Y. Sirt1 modulates premature senescence-like phenotype in human endothelial cells. J Mol Cell Cardiol. 2007;43(5):571-579.
[10] Chen NX, O’Neill KD, Moe SM, et al. Matrix vesicles induce calcification via up-regulation of Runx2 in vascular smooth muscle cells. Kidney Int. 2018;93(5):1026-1038.
[11] Shimizu T, Tanaka T, Iso T, Matsui H, Ooyama Y, Kawai-Kowase K, Arai M, Kurabayashi M. Notch signaling pathway enhances bone morphogenetic protein 2 (BMP2) responsiveness of Msx2 gene to induce osteogenic differentiation and mineralization of vascular smooth muscle cells. J Biol Chem. 2011;286(21):19138-19148.
[12] Ho HJ, Shirakawa H. Oxidative stress and mitochondrial dysfunction in chronic kidney disease. Cells. 2022;12(1):88.
[13] Childs BG, Durik M, Baker DJ, van Deursen JM. Cellular senescence in aging and age-related disease: from mechanisms to therapy. Nat Med. 2015;21(12):1424-1435.
[14] Wang Y, Chen S, Deng C, Li F, Wang Y, Hu X, Shi F, Dong N. MicroRNA-204 targets Runx2 to attenuate BMP-2-induced osteoblast differentiation of human aortic valve interstitial cells. J Cardiovasc Pharmacol. 2015;66(1):63-71.
[15] Liu X, Chen A, Liang Q, Yang X, Dong Q, Fu M, Wang S, Li Y, Ye Y, Lan Z, Chen Y, Ou JS, Yang P, Lu L, Yan J. Spermidine inhibits vascular calcification in chronic kidney disease through modulation of SIRT1 signaling pathway. Aging Cell. 2021;20(6):e13377.
[16] Li L, Liu H, Chai Q, et al. Dapagliflozin targets SGLT2/SIRT1 signaling to attenuate the osteogenic transdifferentiation of vascular smooth muscle cells. Cell Mol Life Sci. 2024;81:448.
[17] Dong W, Zhang K, Gong Z, et al. N-acetylcysteine delays CKD-related kidney injury by activating the sirtuin 1-p53 pathway. Chem Biol Interact. 2023;369:110299.
[18] Yan J, Wang J, He JC, Zhong Y. Sirtuin 1 in chronic kidney disease and therapeutic potential of targeting sirtuin 1. Front Endocrinol (Lausanne). 2022;13:917773.
[19] Fan P, Chen M, Deng B, et al. SIRT1 protects against CKD-induced aortic valve calcification through inhibition of NLRP3 inflammasome. J Am Coll Cardiol. 2024;83(13_Supplement):21
[20] Heerspink HJL, Stefánsson BV, Correa-Rotter R, et al. Dapagliflozin in patients with chronic kidney disease. N Engl J Med. 2020;383(15):1436-1446.
[21] Solomon SD, McMurray JJV, Claggett B, et al. Dapagliflozin in heart failure with mildly reduced or preserved ejection fraction. N Engl J Med. 2022;387(12):1089-1098.
[22] Anker SD, Butler J, Filippatos G, et al. Empagliflozin in heart failure with a preserved ejection fraction. N Engl J Med. 2021;385(16):1451-1461.
[23] Faul C, Amaral AP, Oskouei B, et al. Fibroblast growth factor-23 induces left-ventricular hypertrophy. J Clin Invest. 2011;121(11):4393-4408.
[24] Kiechl S, Schett G, Wenning G, et al. Osteoprotegerin is a risk factor for progressive atherosclerosis and cardiovascular disease. Circulation. 2004;109(18):2175-2180.
[25] Braidy N, Poljak A, Grant R, et al. Mapping NAD⁺ metabolism in the brain of ageing Wistar rats. Cell Cycle. 2014;13(5):729-739.
[26] Deng CX. SIRT1, is it a tumor promoter or tumor suppressor? Int J Biol Sci. 2009;5(2):147-152.
[27] Patel KR, Brown VA, Jones DJ, et al. Clinical pharmacology of resveratrol and its metabolites in colorectal cancer patients. Cancer Res. 2010;70(19):7392-7399.
[28] Fang Y, Tang S, Li X. Sirtuins in metabolic and epigenetic regulation of stem cells. Trends Endocrinol Metab. 2019;30(3):177-188.
[29] Pavek P. Pregnane X receptor (PXR)-mediated gene repression and cross-talk of PXR with other nuclear receptors via coactivator interactions. Front Pharmacol. 2016;7:456.
[30] Li Q, Cheng JC, Jiang Q, Lee WY. Role of sirtuins in bone biology: Potential implications for novel therapeutic strategies for osteoporosis. Aging Cell. 2021 Feb;20(2):e13301.
[31] Purushotham A, Schug TT, Xu Q, et al. Hepatocyte-specific deletion of SIRT1 alters fatty-acid metabolism and results in hepatic steatosis and inflammation. Cell Metab. 2009;9(4):327-338.
[32] Kidney Disease: Improving Global Outcomes (KDIGO) CKD Guideline Development Work Group. KDIGO 2024 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. Kidney Int. 2024;105(4 Suppl):S117–S314.
审批编号:CN-162923, 过期日期:2026-07-07
仅供e学荟平台推送,仅供医疗卫生专业人士参考,不得转发或分享非医疗卫生专业人士。