OPG/RANKL在CKD-MBD与血管钙化中的作用与干预
医脉通 2025.09.02

心内前沿
10条内容
OPG/RANKL在CKD-MBD与血管钙化中的作用与干预
OPG/RANKL/RANK经典骨-免疫学概念
一、 系统发现与命名(1997-2000)
1997年Amgen团队在寻找新的肿瘤坏死因子受体时克隆到一条可溶性“骨保护素”基因,并证实其通过与RANKL竞争性结合抑制破骨细胞分化[1]。其后Yasuda等报道RANK-RANKL为骨髓基质/T细胞-破骨细胞的关键信号,提出“OPG/RANK/RANKL 三元调控轴”(骨保护素Osteoprotegerin、核因子κB受体活化因子配Receptor Activator of Nuclear Factor-κB Ligand、核因子κB受体活化因子、Receptor Activator of Nuclear Factor-κB) [2]。同年OPG-/-小鼠出现进行性骨质疏松和主主动脉钙化,明确了OPG在骨-血管双系统的抑制性功能[3]。
二、 骨重建-免疫交叉理论形成(2000-2010)
进入21世纪,“骨免疫学(Osteoimmunology)”概念提出,强调淋巴细胞-巨噬细胞产生的RANKL、TNF-α、IL-17与破骨细胞形成的耦合关系[4]。此外,雌激素缺乏和炎症性疾病(类风湿关节炎、炎症性肠病)导致的骨丢失被证明与T细胞-RANKL过表达有关,奠定了多学科交叉基础。临床上抗RANKL单抗Denosumab(地舒单抗)于2010年经FDA获批,用于治疗骨质疏松和癌转移(国内2023年起获批,适应症略有不同),验证了该通路在人体内可安全靶向。
三、 从骨到血管的外延
近年来研究发现,血管平滑肌细胞、高磷环境下会表达RANKL并降低OPG,从而激活 NF-κB-Runx2促进钙化;炎症细胞浸润加重此循环[5]。心血管影像学随访显示,高OPG /低 RANKL与冠脉钙化进展减慢、CKD患者全因死亡降低相关[6,7]。与此同时,维生素K依赖蛋白MGP的γ-羧化状态与OPG效应协同,为“骨-血管轴”提供新的干预节点[8]。整体上,OPG/RANKL/RANK已从单纯骨重建调控扩展为骨-免疫-血管三维网络,为CKD-MBD与血管钙化研究奠定概念框架。
CKD-MBD场景下OPG调节因子
一、 炎症
CKD长期慢性炎症可直接驱动OPG上调:TNF-α、IL-1β及CMV即能诱导VSMC表达 OPG,同时促使RANKL-NF-κB回路活化,形成“炎症-OPG/RANKL”正反馈[9]。这一调节既是机体对骨丢失与钙化刺激的代偿,也提示抗炎策略可能间接影响OPG水平。
二、 甲状旁腺激素(PTH)
继发性甲旁亢是CKD-MBD核心特征。体外研究表明,间歇性PTH在成骨细胞中抑制 OPG同时升高RANKL,加速破骨活性[10]。因此,活化型维生素D/钙模仿剂通过抑制PTH可相对提高OPG/RANKL比值,可能有助于延缓钙化。
三、 FGF23
FGF23不仅调磷,还与OPG水平呈正相关:CKD随访显示血清FGF23升高伴OPG升高而RANKL下降,二者组合优于单一指标预测冠脉钙化进展[11]。机制上,FGF23-Klotho轴被认为通过抑制1,25(OH)₂D₃下游信号,间接影响OPG表达。
四、 维生素K
维生素K参与MGP γ-羧化;缺乏时,未羧化-MGP失去对钙盐晶体的抑制作用。动物研究发现补充维生素K₂可上调OPG mRNA并降低RANKL,从而减轻CKD大鼠的动脉钙化[12]。临床观察亦提示低维生素K状态与高OPG/RANKL比值失衡相关,支持在CKD-MBD管理中关注K状态。
OPG与血管/瓣膜钙化的人群随访与影像学证据
一、 冠脉钙化与全人群随访
在英国健康体检队列(n = 2096;平均随访4.6年)中,基线OPG四分位最高者冠状动脉钙化积分(CAC)增速减缓24%,而RANKL四分位最高者增速加快18%;多变量校正后 OPG∶RANKL比值仍独立预测CAC进展 (β = –0.12,P < 0.01) [6]。意大利Bruneck纵向研究亦证实,OPG基线值升高可降低10年动脉粥样硬化进展与心血管事件风险 (HR 0.59;95 %CI 0.40–0.88),提示OPG作为动脉硬化远期保护因子[13]。
二、 CKD/透析队列的前瞻证据
Morena等随访184例血透患者34个月发现,每双倍水平的OPG对应血管钙化评分增长率下降31 %,同时全因死亡风险降低 (HR 0.66;95 %CI 0.46–0.94) [14]。另一项多中心CKD 3-5期前瞻队列 (n = 280) 证实,OPG水平与脉搏波速度及AAC(腹主动脉钙化)同步相关;当OPG> 10.2 pmol/L时,三年血管钙化进展OR 2.1 (P = 0.02)。这些结果强调OPG可作为CKD-MBD患者血管钙化与预后双重监测指标。
三、 瓣膜钙化与心脏结构结局
德国单中心CT及超声队列(n = 137例钙化性主动脉瓣狭窄)显示,血浆OPG与瓣膜钙化体积呈正相关(r = 0.42,P < 0.001);四分位最高组3年内事件自由生存率降低28 % [15]。北欧ASE-AS随访159例轻-中度AS患者4年,发现OPG > 8.9 pmol/L独立预测瓣口面积每年缩小速率(β = –0.18,P < 0.01)及心血管死亡(HR 1.78) [16]。提示OPG不仅反映成骨样活性,也与瓣膜硬化速度及临床结局相关。
动物与细胞实验:OPG直接抗钙化 vs. 代偿升高?
一、 基因缺失与过表达模型——“缺之则钙”
OPG-/-小鼠自3周龄起即出现主动脉及肾动脉中膜钙化,并伴早发骨质疏松,直接证明OPG是体内抑钙化因子[3]。相反,在LDLR-/-与5/6肾切除模型中,肝脏特异性过表达或短期注射Fc-OPG可将von Kossa灰黑面积减少60–70 % ,而对脂斑负荷几乎无影响,提示 OPG“选向”抑制矿化而非粥样硬化[17]。这一正反对照奠定了OPG作为血管钙化直接靶点的实验基础。
二、 VSMC体外试验——阻断成骨化信号
在高磷或BMP-2诱导的人VSMC内,RANKL-Notch1-Msx2轴驱动Runx2、ALP表达并加速钙盐沉积。外加重组OPG 100 ng mL⁻¹可下调成骨基因并将Alizarin Red染色面积降低一半以上,且不影响细胞活力或凋亡[18]。该结果与Fc-OPG动物数据一致,证明OPG具有直接细胞保护作用,并非仅在体内通过系统途径发挥效应。
三、 病理状态中的“代偿升高”
在5/6肾切除、大剂量Vit D或糖尿病大鼠模型中,血浆和动脉壁OPG常显著升高,却仍伴钙化进行。糖尿病大鼠主动脉中OPG含量增1.8 倍,但Ca²⁺沉积与脉搏波速度同步上升;体外人VSMC在TNF-α刺激下亦大量分泌OPG[19]。Collin-Osdoby等总结指出,慢性炎症-氧化应激可诱导OPG表达,反映机体“自救”补偿,但在持续高磷与ROS夹击下,其抑钙化阈值被拖垮[20]。因此,OPG上升在某些病理背景下可能是失衡后的代偿信号,提示单纯监测OPG需结合RANKL及炎症水平解读。
药物与营养干预
一、 地舒单抗——“体外OPG”补充
地舒单抗是全人源化IgG2抗体,可模拟OPG与RANKL高亲和结合而阻断RANKL‒RANK轴。随机对照研究显示,CKD 3–4期女性连续12月使用地舒单抗(60 mg/q6 m)使骨转换标志物CTX降74%,腰椎BMD升4.5%,同时血清RANKL下降而OPG 水平维持[21]。在血液透析患者的小型前瞻队列中,该药将主动脉钙化评分年增速从22%降至8%,并未加重低钙血症风险[22],提示地舒单抗可能成为CKD-MBD钙化抑制的“类OPG”策略。
二、 维生素 K₂──γ-羧化通路协同OPG
维生素K₂(MK-7)是MGP γ-羧化所必需的辅酶。随机对照试验纳入42例非透析CKD 3–5期患者,MK-7 360 µg/d 12个月可显著降低未羧化-MGP(dp-ucMGP)44%,同时 OPG/RANKL比值提高29%,与腹主动脉钙化积分减速独立相关[23]。机制学研究表明,充分γ-羧化的MGP可稳定OPG蛋白构象,增强其对RANKL的竞争力,为“维生素K + OPG轴”提供分子依据。
三、 华法林停药──解除“维生素K剥夺效应”
长期华法林治疗会抑制维生素K依赖蛋白羧化,导致未羧化MGP上调/OPG下调,从而促进钙化。前瞻随访105例房颤患者,华法林组冠脉钙化积分年增速是NOAC组的1.7倍;停用华法林6个月后dp-ucMGP降35%,血清OPG升19%,钙化进展速率趋于NOAC组水平[24]。因此,在CKD-MBD患者如无高危栓塞指征,转换至非维生素K口服抗凝剂或降低INR目标可视为减钙化干预的一环。
四、 雌激素/激素替代治疗(HRT)
雌激素可通过抑制RANKL并提升OPG达到抗破骨与抑钙化“双效”。在36例绝经女性CKD患者的交叉试验中,经皮雌二醇50 µg/d 12周使OPG升25%、RANKL降低18%,脉搏波速度(PWV)改善0.6 m/s;停药后各指标回弹[25]。大样本WHI-CAC副研究亦显示,接受雌激素者冠脉钙化体积分布较安慰剂低20%(n = 1064)[26]。不过HRT需权衡乳腺/血栓风险,且在重度CKD患者中数据有限,未来可探讨低剂量经皮制剂联合选择性雌激素受体调节剂以最大化OPG-RANKL益处。
研究缺口与未来方向
一、 OPG-SIRT1-Smad3精准互作机制尚不清晰
现有体外研究提示,SIRT1 去乙酰化 Smad3 可上调OPG表达,可能通过TGF-β/Smad 轴增强其抗钙化效应。但具体调控层级、共激活因子及染色质结合位点仍不明确,尚无ChIP-seq或CUT&Tag等高通量验证,亦缺乏细胞类型特异的调控图谱。未来可借助单细胞ATAC-seq与染色质互作组学描绘该信号在VSMC与肾小管上皮间的差异性,以明确SIRT1-OPG是直接转录调控,还是间接反馈机制。
二、 OPG做伴随诊断的临床阈值尚未建立
OPG浓度与血管钙化风险、心血管事件具有相关性,但目前临床应用缺乏明确的“高危”截断值。多项研究使用四分位分析或对数转换后模型预测,而未形成统一的临床诊断标准[27]。此外,OPG水平受炎症、性别、年龄和糖脂代谢干扰,在CKD人群中变异性更大。因此亟需基于多中心人群的参考区间建立,并结合ROC曲线确定预测血管钙化或事件的灵敏度与特异度,推动OPG向伴随诊断生物标志物转化。
三、 CKD各分期的OPG信号特征尚不明晰
多数研究将CKD患者作为整体纳入,未按eGFR分期或是否透析状态进行亚组解析。然而临床发现,OPG在CKD3–4期升高趋势不显,而在进入透析或ESRD后急剧升高[28]。这可能涉及肾源性清除下降、骨代谢紊乱及炎症风暴等共同作用。未来应分期构建“CKD-MBD–OPG”模型,明确在CKD3a-5各阶段中OPG的水平、预测价值及对干预(如维生素K、地舒单抗)的反应差异,从而为精准治疗提供分层依据。
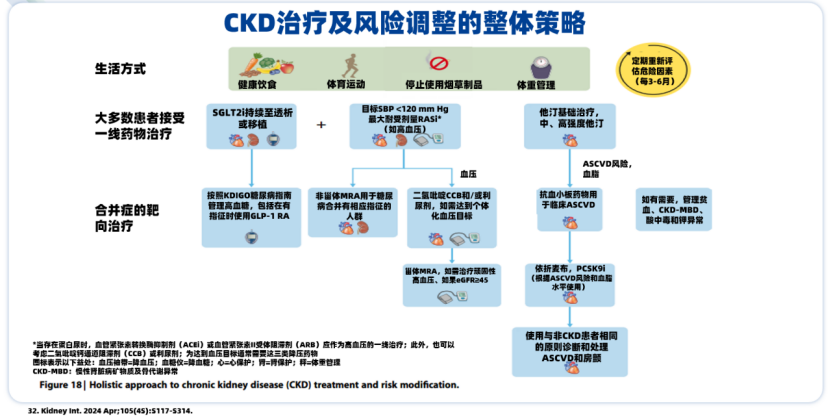
附:CKD-MBD治疗小贴士
CKD-MBD患者,2024版《KDIGO慢性肾脏病评价与管理指南》[32]建议维持健康生活方式的同时,大多数患者需接受对症药物治疗。
参考文献:
[1] Simonet WS, Lacey DL, Dunstan CR, et al. Osteoprotegerin: a novel secreted protein involved in the regulation of bone density. Cell. 1997;89(2):309-319.
[2] Yasuda H, Shima N, Nakagawa N, et al. Osteoclast differentiation factor is a ligand for osteoprotegerin/osteoclastogenesis-inhibitory factor and is identical to TRANCE/RANKL. Proc Natl Acad Sci USA. 1998;95(7):3597-3602.
[3] Bucay N, Sarosi I, Dunstan CR, et al. Osteoprotegerin-deficient mice develop early onset osteoporosis and arterial calcification. Genes Dev. 1998;12(9):1260-1268.
[4] Arron JR, Choi Y. Bone versus immune system. Nature. 2000 Nov 30;408(6812):535-6.
[5] Zhang D, Bi X, Liu Y, Huang Y, Xiong J, Xu X, Xiao T, Yu Y, Jiang W, Huang Y, Zhang J, Zhang B, Zhao J. High Phosphate-Induced Calcification of Vascular Smooth Muscle Cells is Associated with the TLR4/NF-κb Signaling Pathway. Kidney Blood Press Res. 2017;42(6):1205-1215.
[6] Venuraju SM, Yerramasu A, Corder R, Lahiri A. Osteoprotegerin as a predictor of coronary artery disease and cardiovascular mortality and morbidity. Heart. 2010;96:1738-1744.
[7] Marques GL, Hayashi S, Bjällmark A, Larsson M, Riella M, Olandoski M, Lindholm B, Nascimento MM. Osteoprotegerin is a marker of cardiovascular mortality in patients with chronic kidney disease stages 3-5. Sci Rep. 2021 Jan 28;11(1):2473.
[8] Jespersen T, Møllehave LT, Thuesen BH, Skaaby T, Rossing P, Toft U, Jørgensen NR, Corfixen BL, Jakobsen J, Frimodt-Møller M, Linneberg A. Uncarboxylated matrix Gla-protein: A biomarker of vitamin K status and cardiovascular risk. Clin Biochem. 2020 Sep;83:49-56.
[9] Dutka M, Bobiński R, Wojakowski W, Francuz T, Pająk C, Zimmer K. Osteoprotegerin and RANKL-RANK-OPG-TRAIL signalling axis in heart failure and other cardiovascular diseases.
[10] Rochette L, Meloux A, Rigal E, Zeller M, Cottin Y, Vergely C. The Role of Osteoprotegerin and Its Ligands in Vascular Function. Int J Mol Sci. 2019 Feb 6;20(3):705.
[11] Mirza MA, Larsson A, Melhus H, Lind L, Larsson TE. Serum intact FGF23 associate with left ventricular mass, hypertrophy and geometry in an elderly population. Atherosclerosis. 2009 Dec;207(2):546-51.
[12] McCabe KM, Booth SL, Fu X, Shobeiri N, Pang JJ, Adams MA, Holden RM. Dietary vitamin K and therapeutic warfarin alter the susceptibility to vascular calcification in experimental chronic kidney disease. Kidney Int. 2013 May;83(5):835-44.
[13] Kiechl S, Schett G, Wenning G, et al. Osteoprotegerin is a risk factor for progressive atherosclerosis and cardiovascular disease. Circulation. 2004;109:2175-2180.
[14] Morena M, Terrier N, Jaussent I, Leray-Moragues H, Chalabi L, Rivory JP, Maurice F, Delcourt C, Cristol JP, Canaud B, Dupuy AM. Plasma osteoprotegerin is associated with mortality in hemodialysis patients. J Am Soc Nephrol. 2006 Jan;17(1):262-70.
[15] Weiss RM, Lund DD, Chu Y, Brooks RM, Zimmerman KA, El Accaoui R, Davis MK, Hajj GP, Zimmerman MB, Heistad DD. Osteoprotegerin inhibits aortic valve calcification and preserves valve function in hypercholesterolemic mice. PLoS One. 2013 Jun 6;8(6):e65201.
[16] Ueland T, Aukrust P, Dahl CP, Husebye T, Solberg OG, Tønnessen T, Aakhus S, Gullestad L. Osteoprotegerin levels predict mortality in patients with symptomatic aortic stenosis. J Intern Med. 2011 Nov;270(5):452-60.
[17] Morony S, Tintut Y, Zhang Z, et al. Osteoprotegerin inhibits vascular calcification without affecting atherosclerosis in ldlr-/- mice. Circulation. 2008;117:411-420.
[18] Zhou S, Fang X, Xin H, et al. Osteoprotegerin inhibits calcification of vascular smooth muscle cells via down-regulation of the Notch1-RBP-Jκ/Msx2 signalling pathway. PLoS One. 2013;8:e68987. PMID: 23874840.
[19] Olesen P, Ledet T, Rasmussen LM. Arterial osteoprotegerin: increased amounts in diabetes and modifiable synthesis from vascular smooth muscle cells by insulin and TNF-α. Diabetologia. 2005;48:561-568.
[20] Collin-Osdoby P. Regulation of vascular calcification by osteoclast regulatory factors RANKL and osteoprotegerin. Circ Res. 2004;95:1046-1057.
[21] Broadwell A, Chines A, Ebeling PR, Franek E, Huang S, Smith S, Kendler D, Messina O, Miller PD. Denosumab Safety and Efficacy Among Participants in the FREEDOM Extension Study With Mild to Moderate Chronic Kidney Disease. J Clin Endocrinol Metab. 2021 Jan 23;106(2):397-409.
[22] Kato K, Yaginuma T, Kobayashi A, Nakashima A, Ohkido I, Yokoo T. Long-term effects of denosumab on bone mineral density and turnover markers in patients undergoing hemodialysis. J Bone Miner Metab. 2024 Mar;42(2):264-270.
[23] Kurnatowska I, Grzelak P, Masajtis-Zagajewska A, et al. Effects of vitamin K2 on progression of atherosclerosis and vascular stiffness in nondialyzed patients with chronic kidney disease. Pol Arch Med Wewn. 2015;125(9):631-640.
[24] van Gorp RH, Baaten CCFMJ, Habibi A, Jaminon AMG, Peeters FECM, Leenders P, Crijns HJGMC, Heemskerk JWM, Reutelingsperger CP, Spronk HM, Schurgers LJ. Vitamin K antagonist use induces calcification and atherosclerotic plaque progression resulting in increased hypercoagulability. Eur Heart J Open. 2021 Aug 6;1(2):oeab017.
[25] Fujiwara Y, Piemontese M, Liu Y, Thostenson JD, Xiong J, O'Brien CA. RANKL (Receptor Activator of NFκB Ligand) Produced by Osteocytes Is Required for the Increase in B Cells and Bone Loss Caused by Estrogen Deficiency in Mice. J Biol Chem. 2016 Nov 25;291(48):24838-24850.
[26] Manson JE, Allison MA, Rossouw JE, et al. Estrogen therapy and coronary-artery calcification. N Engl J Med. 2007;356(25):2591-2602.
[27] Nascimento MM, Hayashi SY, Riella MC, Lindholm B. Elevated levels of plasma osteoprotegerin are associated with all-cause mortality risk and atherosclerosis in patients with stages 3 to 5 chronic kidney disease. Braz J Med Biol Res. 2014 Nov;47(11):995-1002.
[28] Collado S, Coll E, Nicolau C, Azqueta M, Pons M, Cruzado JM, de la Torre B, Deulofeu R, Mojal S, Pascual J, Cases A. Serum osteoprotegerin in prevalent hemodialysis patients: associations with mortality, atherosclerosis and cardiac function. BMC Nephrol. 2017 Sep 7;18(1):290.
[29] Kidney Disease: Improving Global Outcomes (KDIGO) CKD Guideline Development Work Group. KDIGO 2024 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. Kidney Int. 2024;105(4 Suppl):S117–S314.
审批编号:CN-162924, 过期日期:2026-07-07
仅供e学荟平台推送,仅供医疗卫生专业人士参考,不得转发或分享非医疗卫生专业人士。