GI医声 第10期 I 从ctDNA到靶向、免疫治疗,探索消化道肿瘤精准治疗新突破
医脉通 2023.12.20

GI 医声
13条内容

导读:结直肠癌和胃肠间质瘤都是全球常见的消化道恶性肿瘤,我国消化道肿瘤发病率和死亡率均位居全球前列,如何提高消化道肿瘤诊断、治疗水平,是近年来的临床关注热点。随着技术的迅速发展,肿瘤治疗已进入“精准肿瘤学时代”,ctDNA检测可指导消化道肿瘤的治疗决策,靶向、免疫治疗也已获取明显的临床效益。在此背景下,本期GI医声特邀北京大学肿瘤医院李健教授、南京大学医学院附属鼓楼医院钱晓萍教授、广州中医药大学第一附属医院周京旭教授分享消化道肿瘤领域的前沿进展,以飨读者。

研究背景
瑞戈非尼已被批准用于转移性胃肠间质瘤(mGIST) 的 3 线治疗, GRID 研究中,瑞戈非尼3线治疗GIST中位无进展生存期 (mPFS) 达到4.9 个月1。瑞戈非尼可通过调节肿瘤相关巨噬细胞极化、减少Tregs浸润等多种机制缓解mGIST免疫抑制的肿瘤微环境。Avelumab是一种完全人源化的PD-L1 IgG1单抗,能够有效地阻止PD-L1与PD-1的结合。将抗血管生成药物与PD-1/PD-L1 抑制剂药物联合在前期mGIST人群中极具治疗前景。2023 ESMO大会公布了一项瑞戈非尼联合Avelumab治疗mGIST的临床研究,为临床实践带来了循证依据2。
研究方法
这是一项单臂、开放标签、多中心II期试验,评估瑞戈非尼(160 mg QD, Q3W/ Q4W)联合Avelumab (10 mg/kg,Q2W)在mGIST患者中的疗效和安全性,研究主要终点是中央审查后经RECIST 1.1标准评估的6个月无进展率(PFR)。次要终点包括6个月客观缓解率(ORR),1年PFS,1年总生存期(OS)及安全性。计划从基线获得的患者肿瘤样本中进行相关研究。
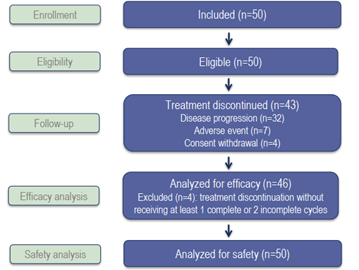
图1 研究设计
研究结果
2018年11月至2022年7月,在6个中心招募了50例mGIST患者。中位既往治疗线数为二线(范围:1-4)。
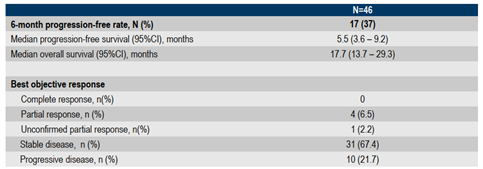
在46例疗效可评估的患者中,6个月的PFR为37% (N=17):其中4例(8.7%)部分缓解(PR),31例(67.4%)疾病稳定(SD),10例(21.7%)疾病进展(PD),1例(2.2%)无法评估(表1)。
46例可评估患者mPFS和mOS分别为5.5个月(95% Cl:3.6-7.5)和17.7个月(95% Cl:13.7 -29.3)。29.3%的患者在一年内未发生进展。6个月和1年的OS率分别为95.6% (95%Cl:83.5-98.9)和72.7.% (95%Cl:56.9-83.5)(表1)。
表1 患者PFS、OS、最佳缓解客观缓解数据
24例(52.2%)患者肿瘤缩小。
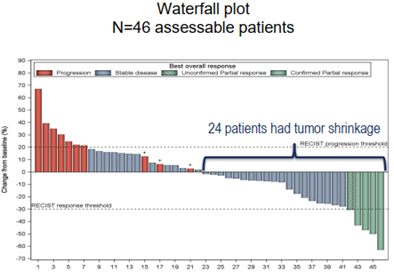
图2 与基线相比患者肿瘤大小变化
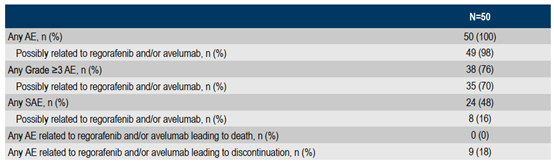
≥3级不良事件的发生率为76%,最常见的≥3级不良事件是:掌跖红肿综合征(18%)、高血压(18%)、腹泻(12%),斑丘疹(12%)。没有患者发生死亡相关不良事件。
表3 患者安全性数据
研究结论
Regomune 是首个评估经批准 TKI联合免疫治疗药物治疗mGIST的前瞻性研究,瑞戈非尼联合Avelumab在晚期mGIST患者中耐受性良好,且部分患者获得了长期的临床获益。未来仍需要进一步的研究证实。
专家锐评

瑞戈非尼是口服多靶点酪氨酸激酶抑制剂(TKI),不仅能够通过作用于VEGFR1/2/3、c-Kit等靶点而抑制肿瘤生长和血管生成,还可以发挥调节免疫微环境的作用。其作为GIST的标准三线治疗药物已经有近10年的历史。2017年在国内上市,被批准用于治疗既往接受过伊马替尼及舒尼替尼治疗的局部晚期、无法手术切除或转移性的GIST患者。GRID研究证明瑞戈非尼用于经伊马替尼和舒尼替尼治疗后发生疾病进展的GIST患者中,与安慰剂相比能够显著改善患者的PFS(4.4个月 vs 0.9个月,P < 0. 0001)1。
临床前研究显示,在伊马替尼难治性GIST中,效应T细胞减少,巨噬细胞M2 TAM富集;免疫检查点抑制剂(ICIs)可增强CD8+T细胞的杀伤作用,提示ICIs可能是难治性GIST的潜在治疗选择。然而,ICIs治疗mGIST的疗效有限,Alliance A091401研究3,PEMBROSARC研究5以及一项纳武利尤单抗±伊匹木单抗治疗mGIST的随机II期对照研究均显示,ICIs治疗mGIST的效果不理想,患者ORR为0。此外,一项帕博利珠单抗治疗mGIST的回顾性研究也显示,患者未实现客观缓解6。而TKI靶向治疗药物具有免疫增效作用。GIST的肿瘤微环境存在严重的免疫细胞浸润,其中T细胞和M2巨噬细胞占优势。TKI靶向药物可以通过减少调节性T细胞数量缓解局部免疫抑制情况,并可通过提高局部CD8+T细胞和自然杀伤细胞的数量和活性而增强细胞免疫。研究表明,抗血管生成TKI药物瑞戈非尼联合ICIs治疗存在协同增效作用。瑞戈非尼可阻断CSF-1/CSF-1R介导的M2 TAM浸润,并通过靶向作用于RET-Src轴和BRAF,进而减弱IFNγ诱导的PD-L1表达,增强免疫作用。因此,当TKI靶向治疗药物与ICIs联用时,可以增强免疫治疗药物在GIST中的免疫学反应,显著提高患者治疗效果7,8。
此次2023 ESMO大会公布的一项瑞戈非尼联合Avelumab治疗mGIST的临床研究,进一步探索了靶向、免疫联合治疗在mGIST患者中的疗效与安全性,结果显示,6个月PFS率17%,PFS达到5.5个月,确认的ORR为 6.5%,亚组数据显示靶免治疗对于胃原发GIST 获益更高2。瑞戈非尼联合Avelumab治疗GIST患者的生存获益较GRID 研究中瑞戈非尼单药治疗的4.8个月PFS有所延长。未来有望进一步扩大GIST获益人群。期待将来更多基础研究和大样本前瞻性临床试验的深入挖掘,为GIST靶向联合免疫治疗的应用提供更多的策略。

研究背景
瑞戈非尼的作用机制涉及多个靶点,覆盖肿瘤发生、发展的各个环节,通过抑制VEGFR-1、VEGFR-2、VEGFR-3,抑制肿瘤新血管生成;通过作用于FGFR,改善肿瘤微环境;通过抑制KIT和BRAF,抑制肿瘤生长;通过作用于CSF1R,达到免疫增敏的协同效果等。ctDNA已经成为肿瘤临床诊疗特别是结直肠癌(CRC)诊疗及预后预测的重要临床工具。目前,瑞戈非尼还没有明确的预测性生物标志物,本研究的主要目的是了解瑞戈非尼治疗期间的ctDNA动力学,并确定其与转移性结直肠癌患者治疗结果的关系9。
研究方法
这是一项前瞻性生物标志物研究,2013~2015年,共110名患者被纳入生物标志物分析,使用包含106份基因样本的NGS平台在基线首次肿瘤反应评估时、瑞戈非尼治疗(160mg QD,第1~21天治疗,28天一个周期)两个周期后和疾病进展时进行ctDNA样本测序。
图1 研究设计
研究结果
基线ctDNA分析
共107例患者基线进行了血液ctDNA分析,单因素COX比例分析显示,基线ctDNA浓度与患者生存期具有显著相关性,基线cfDNA浓度越高,患者PFS和OS越差,高cfDNA浓度和低cfDNA浓度中位PFS分别为3.7个月 vs.6.3个月(P=0.006),中位OS分别为6.9个月 vs.12.8个月(P<0.001)。
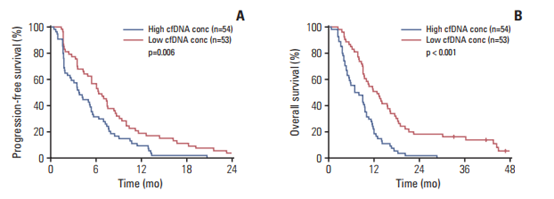
图2 基线高/低ctDNA浓度的PFS和OS数据
在基线ctDNA可检测的107例患者中,94.4%(101例)检测到至少一种基因突变。在单变量分析中,与野生型患者相比,基线TP53突变、KRAS突变、FGFR1扩增与较差的PFS和OS获益相关,然而这一差异在多变量分析中并不明显。
瑞戈非尼治疗2个月后ctDNA分析
瑞非尼治疗2个周期后,单因素变量分析中,TP53、APC、TCF7L2和ROS1的VAF降低与PFS延长相关。
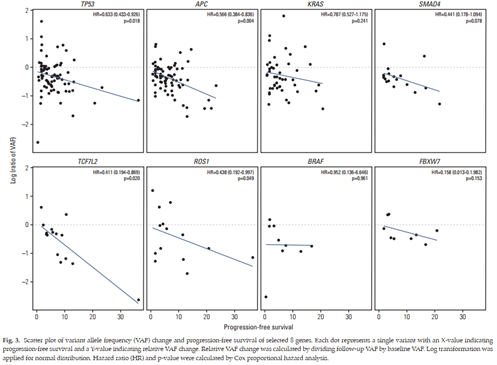
图3 不同基因突变VAF变化与PFS散点图
变异等位基因频率(VAF)降低与更长的PFS相关,瑞戈非尼治疗2个周期后,大多数ctDNA突变的VAF下降,平均降低31.6%。与VAF降低<50%相比,VAF降低≥50 %具有更长的PFS (6.1个月vs 2.7个月,p=0.002)、OS (11.3个月vs 5.9个月,p= 0.001) 和更高的疾病控制率 (86.3% vs 51.1%, p<0.001)。
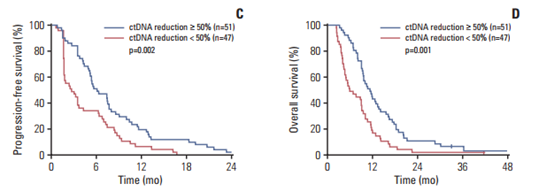
图4 不同ctDNA变化(通过VAF测量:VAF≥50%/<50 %)的PFS和OS数据
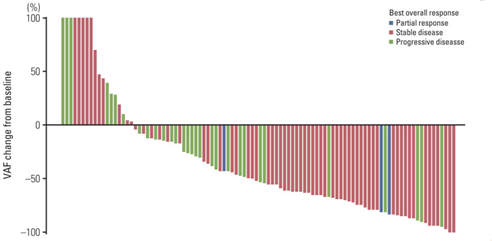
图5 瑞戈非尼治疗2个周期后VAF变化瀑布图
疾病进展时ctDNA分析
患者基线、瑞戈非尼治疗两个月后和疾病进展是的平均VAF分别为12.95%、7.72%、11.58%。提示经瑞戈非尼治疗后患者VAF水平下降,疾病进展后VAF水平升高。且大多数ctDNA突变的VAF在疾病进展时升高,BRAF的VAF明显升高。
研究结论
ctDNA负荷减少(VAF减少)是瑞戈非尼治疗获益的预测生物标志物。
专家锐评

ctDNA在早期CRC中的主要应用之一是检测分子残留疾病(MRD)。MRD通常指根治性手术后残留的远处隐匿性肿瘤,其肿瘤体积小于放射学检测的最低限度,但可通过分子技术进行测量。其具体含义均为根治性手术后可检测到的ctDNA。ctDNA已经成为肿瘤临床诊疗特别是CRC诊疗及预后预测的重要临床工具,其半衰期短,从数分钟到数小时不等,可以更准确、更实时的反馈疾病状态。研究显示,ctDNA水平与肿瘤负荷存在相关性,且在治疗疗效的预测方面优于常规肿瘤标志物。
在该研究中,前瞻性的收集了患者连续是血液样本来探索ctDNA动力学,发现接受瑞戈非尼治疗的结直肠癌患者中,ctDNA浓度升高与患者生存获益存在负相关。瑞戈非尼治疗后,ctDNA VAF降低,显著改善患者的生存获益,这提示ctDNA VAF变化是比放射学反应更敏感的抗肿瘤预测标志物。
结直肠癌中常存在多个基因突变(如BRAF、CSF1R、FGFR1、KDR、KIT、PDGFR-B和RET等)。瑞戈非尼治疗两个周期后,ctDNA突变的 VAF下降,平均降低31.6%,这些基因突变不影响瑞戈非尼的整体治疗效果。表明瑞戈非尼在结直肠癌中的疗效不受多个基因突变的影响,这可能与瑞戈非尼的多激酶抑制活性有关,
该项研究是迄今为止评估ctDNA在接受瑞戈非尼治疗的mCRC中疗效的最大的前瞻性研究,结果表明ctDNA动力学可作为识别接受瑞戈非尼治疗mCRC患者肿瘤异质性的宝贵工具,期待未来该领域内专家学者探索不止,为mCRC患者带来更多获益。

研究背景
短程放疗(SCRT)或长程放化疗(LCRT)联合化疗是局晚期直肠癌(LARC)新辅助治疗的标准方式之一,然而预后仍有待进一步提高。为了探索更优的治疗方式,既往曾开展过一项单臂II期研究,旨在探索SCRT序贯卡瑞利珠单抗联合化疗的疗效。结果显示出了令人鼓舞的pCR率(48.1%),同时安全性良好。本研究旨在对比SCRT联合卡瑞利珠单抗和化疗对比LCRT联合化疗在围术期治疗LARC的疗效和安全性10。
研究设计
研究纳入231例直肠腺癌(临床分期T3-T4或N+)、既往未接受过抗肿瘤治疗且适合手术、肿瘤下缘距离肛缘<10cm、ECOG 评分0或1的患者。按1:1的比例随机分配到CAM+CAPOX组或CAPOX组,并根据临床T分期(≤T3 vs. T4)和N分期(N0 vs. N+)进行分层。主要终点是病理完全缓解率(pCR)。关键次要终点为3年无事件生存率(3y-EFS)和总生存期(OS),其他次要终点包括R0切除率、新辅助治疗完成率、3年无病生存率、肿瘤退缩分级、安全性和生活质量等。
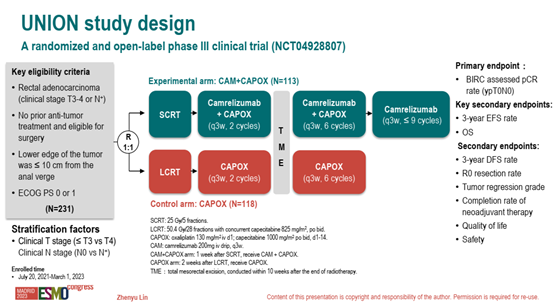
图1 UNION研究的试验设计
研究结果
2021年7月至2023年3月,共231例患者入组。随机分配至CAM+CAPOX组(113例)和CAPOX组(118例)。
CAM+CAPOX组中112例患者接受了SCRT, 107例完成新辅助治疗,104例接受了手术。CAPOX组115例接受了LCRT,109例完成新辅助治疗,99例接受了手术。
意向治疗(ITT)人群中盲态独立审查委员会(BIRC)评估的pCR率CAM+CAPOX组(39.8% [95% CI,30.7-49.5])与CAPOX组相比(15.3% [95% CI,9.3-23.0])显著提高(OR=3.7 [95% CI,2.0-6.9],P<0.001)。
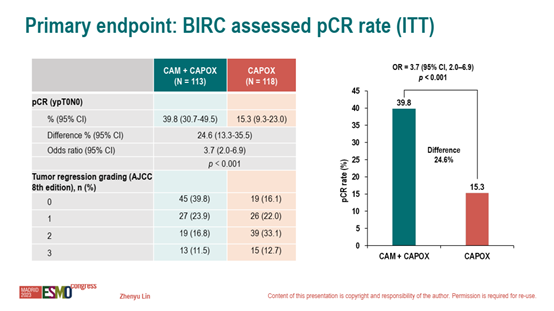
图2 BIRC评估的pCR率
亚组分析显示,各亚组与主分析结果一致。CAM + CAPOX组的中位肿瘤退缩率达到98%,CAPOX组为85%。在手术人群中,CAM+CAPOX组和CAPOX组的R0切除率分别为96.2%和97.0%,保肛率分别为94.2%和89.9%。
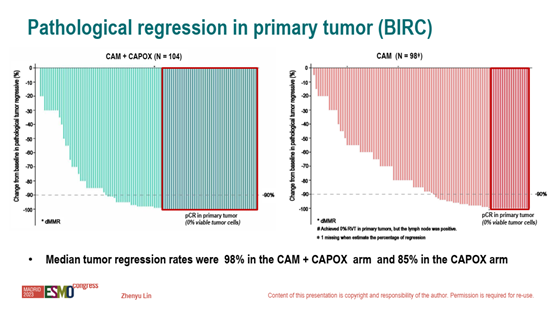
图3 原发灶病理退缩
表1 手术结果
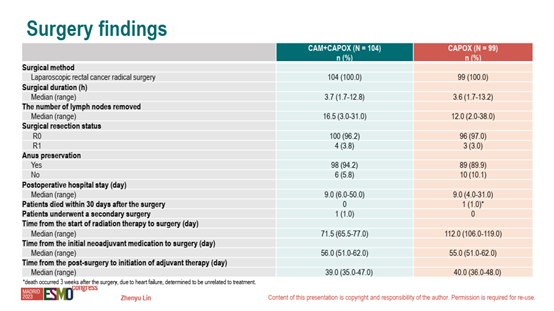
安全性方面,两组不良事件发生率未见显著差异。目前长期生存终点3y-EFS和OS正在随访中。
研究结论
UNION研究是全球首个评估SCRT序贯免疫治疗联合化疗治疗LARC的Ⅲ期研究。与CAPOX组相比,CAM+CAPOX组的pCR率显著优于CAPOX组,达到了主要终点。CAM+CAPOX组表现出可耐受的安全性,新辅助治疗不影响手术的可行性。SCRT序贯卡瑞利珠单抗联合化疗可推荐为LARC患者的围手术期治疗方式。
专家锐评

局晚期直肠癌(LARC)因其术后较高的局部复发率及肛门功能保留问题成为临床工作的难点之一。同步放化疗可显著提高手术切除率,降低局部复发率,并提高保肛率,是目前LARC的标准新辅助治疗模式。
随着基因分子生物学和肿瘤免疫学的发展,免疫疗法成为肿瘤治疗的“新贵”。在MSI-H晚期肠癌患者中,PD-1/PD-L1抑制剂已显示出了良好的疗效和安全性。但具有MSI-H分子特征的直肠癌患者较少,多数是对单纯免疫治疗不敏感的MSS型肠癌。因此,如何提高MSS型肠癌对于免疫治疗的疗效成为研究热点。
有研究发现,放疗具有重塑肿瘤免疫微环境、促进抗肿瘤免疫应答的作用,包括释放肿瘤抗原、促进肿瘤浸润T细胞(TIL)的聚集、诱导肿瘤组织PD-L1表达上调、增强T细胞源性抗肿瘤细胞因子的分泌等。临床上发现,放疗联合免疫治疗可引起“远隔效应”。同时,免疫治疗有利于解除T细胞抑制,增强放疗对局部肿瘤的杀灭作用。在理论上,放疗和免疫治疗具有“相互增敏”的作用。因此,放疗有望成为与免疫治疗相结合的最佳治疗方案之一11,12。
UNION研究是全球首个评估SCRT序贯免疫治疗联合化疗治疗LARC的Ⅲ期研究。结果显示,与CAPOX组相比,CAM+CAPOX组的pCR率显著优于CAPOX组,达到了主要终点。SCRT序贯卡瑞利珠单抗联合化疗可推荐为LARC患者的围手术期治疗方式10。该研究的3y-EFS率和OS数据尚未成熟,目前试验仍在进行中,期待后续更新数据的揭晓。对于局部晚期直肠癌,新辅助放化疗联合免疫治疗未来可期。
参考文献
1. Demetri GD,et al. Efficacy and safety of regorafenib for advanced gastrointestinal stromal tumours after failure of imatinib and sunitinib (GRID): an international, multicentre, randomised, placebo-controlled, phase 3 trial. Lancet. 2013 Jan 26;381(9863):295-302.
2. Cousin S,et al. Regomune: A phase II study of regorafenib + avelumab in solid tumors - Results of the advanced or metastatic gastrointestinal stromal tumors (mGIST) cohort. 2023 ESMO Abstract 1920MO.
3. James LC, et al. A multicenter phase II study of nivolumab +/- ipilimumab for patients with metastatic sarcoma (Alliance A091401): Results of expansion cohorts. 2023 ASCO Abstract 11511.
4. Toulmonde M, et al. Use of PD-1 Targeting, Macrophage Infiltration, and IDO Pathway Activation in Sarcomas: A Phase 2 Clinical Trial. JAMA Oncol. 2018 Jan 1;4(1):93-97.
5. Singh AS, et al. A Randomized Phase II Study of Nivolumab Monotherapy or Nivolumab Combined with Ipilimumab in Patients with Advanced Gastrointestinal Stromal Tumors . Clin Cancer Res. 2022;28(1):84-94.
6. Reddy R, et al. Indian experience with immunotherapy in sarcoma and gastrointestinal stromal tumors: a retrospective study. Future Sci OA. 2022;8(5):FSO795
7. 刘芳岑,邱毓灵,王琴,等. 胃肠道间质瘤伊马替尼耐药机制研究进展:从经典视角到免疫微环境视角. 肿瘤综合治疗电子杂志. 2022;8(3):26-30..
8. 赵文毅,等. 胃肠间质瘤靶向联合免疫治疗——希望与挑战并存时代的来临. 中华胃肠外科杂志. 2017;20(9):966-971.
9. Lee DW, et al. Circulating Tumor DNA Dynamics and Treatment Outcome of Regorafenib in Metastatic Colorectal Cancer. Cancer Res Treat. 2023;55(3):927-938.
10. Zhang T, et al.Neoadjuvant short-course radiotherapy followed by camrelizumab plus chemotherapy versus long-course chemoradiotherapy followed by chemotherapy in locally advanced rectal cancer: A randomized phase III trial (UNION).2023 ESMO LBA25.
11. Wang Y, et al.Neoadjuvant chemoradiotherapy combined with immunotherapy for locally advanced rectal cancer: A new era for anal preservation. Front Immunol. 2022 Dec 8:13:1067036.
12. 姜玉娟, 等. 局部进展期直肠癌新辅助治疗策略研究进展. 肿瘤防治研究.2022年第3期235-239.
